题目内容
1.下列实验装置正确的是( )| A. |  实验室制乙烯 | B. |  酯化反应 | ||
| C. | 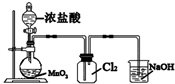 实验室制取Cl2 | D. | 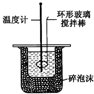 中和热的测定 |
分析 A.实验室制取乙烯需要170℃,温度计测量温度为溶液温度;
B.酯化反应中导气管不能伸入饱和碳酸钠溶液中;
C.制取氯气时,尾气处理应该要防止倒吸;
D.中和热测定中,温度计测量混合溶液温度,用环形玻璃棒搅拌溶液.
解答 解:A.实验室制取乙烯需要170℃,温度计测量温度为溶液温度,所以温度计应该插入溶液中,故A错误;
B.酯化反应中导气管不能伸入饱和碳酸钠溶液中,否则易产生倒吸现象,故B错误;
C.制取氯气时,尾气处理应该要防止倒吸,尾气处理装置中应该有倒置的漏斗,故C错误;
D.中和热测定中,温度计测量混合溶液温度,用环形玻璃棒搅拌溶液,使溶液温度混合均匀,符合实验条件,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生基本操作能力,明确实验原理及基本操作规范性是解本题关键,易错选项是B,注意B中试管中用饱和碳酸钠溶液而不是氢氧化钠溶液,为易错点.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
11.三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是( )
| A. | 三种气体密度最小的是X | |
| B. | 分子数目相等的三种气体,质量最大的是Y | |
| C. | 若一定条件下,三种气体体积均为2.24L,则它们的物质的量一定均为0.1mol | |
| D. | 20℃时,若2molY与1molZ体积相等,则Y、Z气体所承受的压强比为2:1 |
12.下列物质用途的叙述中,不正确的是( )
| A. | 硅可以用作制造太阳能电池 | B. | 二氧化硅可以用于制造光导纤维 | ||
| C. | 石墨可用作绝缘材料 | D. | 石英晶体可用于制造光学仪器 |
16.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 46 g NO2含有氧原子数为2NA | |
| B. | 常温常压下,22.4 L N2含有的分子数为NA | |
| C. | 1 L 1 mol•L-1 Al2(SO4)3溶液中含SO${\;}_{4}^{2-}$数目为NA | |
| D. | 1 mol Fe在足量Cl2中燃烧,转移电子数为2NA |
6.氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.
(1)请写出工业上由NH3制取NO的化学方程式4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$ 4NO+6H2O.
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.
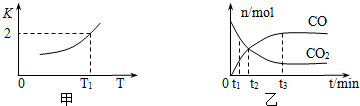
①该反应的逆反应是放热(填“吸热”或“放热”)反应.
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是A.
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为$\frac{2}{3}$,平衡时混合气体的密度与起始时气体的密度之比为$\frac{25}{33}$.
(3)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2?2NH3,有关数据及平衡状态特定见表.
起始时乙容器中的压强是甲容器的0.8倍.
(4)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 $\frac{6}{7}$倍.请写出该反应的热化学方程式4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g)△H=-60bkJ•mol-1.
(1)请写出工业上由NH3制取NO的化学方程式4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$ 4NO+6H2O.
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.

①该反应的逆反应是放热(填“吸热”或“放热”)反应.
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是A.
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为$\frac{2}{3}$,平衡时混合气体的密度与起始时气体的密度之比为$\frac{25}{33}$.
(3)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2?2NH3,有关数据及平衡状态特定见表.
| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | 同种物质的体积分数相同 |
| 乙 | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
(4)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 $\frac{6}{7}$倍.请写出该反应的热化学方程式4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g)△H=-60bkJ•mol-1.
13.青奥中心外墙的复合保温材料采用铝合金锁边.有关铝合金的性质正确的是( )(填字母).
| A. | 强度小 | B. | 耐腐蚀 | C. | 密度大 |
10.下列化合物中含有2个手性碳原子的是( )
| A. | 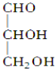 | B. | 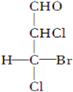 | C. | 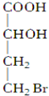 | D. | 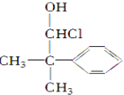 |
11.下列过程中△H大于零的是( )
| A. | 碳的燃烧 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 锌粒与稀H2SO4反应制取H2 |