题目内容
15.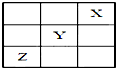 元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )
元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )| A. | X元素所在周期中所含非金属元素最多 | |
| B. | Y元素在周期表的第3周期ⅥA族 | |
| C. | Y元素基态原子的价电子排布为4s24p4 | |
| D. | Z元素基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
分析 Y元素原子的外围电子排布为ns(n-1)npn+1,由于s能级只能容纳2个电子,且p能级已填充电子,故n=3,则Y为S元素,结合元素相对位置可知,X为F元素、Z为As,据此解答.
解答 解:Y元素原子的外围电子排布为ns(n-1)npn+1,由于s能级只能容纳2个电子,且p能级已填充电子,故n=3,则Y为S元素,结合元素相对位置可知,X为F元素、Z为As.
A.X为F元素,所在周期含有非金属元素最多,故A正确;
B.Y元素原子的外围电子排布为3s23p4,Y处于第三周期ⅥA族,故B正确;
C.由上述分析可知n=3,则Y元素原子的外围电子排布为3s23p4,故C错误;
D.Z处于第四周期VA族,原子的核外电子排布式为1s22s22p63s23p63d104s24p3,故D正确,
故选C.
点评 本题考查结构与物质关系、元素周期表、核外电子排布等,比较基础,注意对元素周期表的整体把握,有利于基础知识的巩固.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
5.氯原子M能层含有的轨道数为( )
| A. | 4 | B. | 5 | C. | 7 | D. | 9 |
6.氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
| A. | 再通入少量氯气,$\frac{C({H}^{+})}{C(Cl{O}^{-})}$减小 | |
| B. | 通入少量SO2,溶液漂白性增强 | |
| C. | 加入少量固体NaOH,溶液呈中性时,c(Na+)=c(Cl-)+c(ClO-) | |
| D. | 加入少量水,水的电离平衡向正反应方向移动 |
3.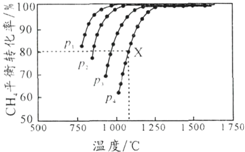 向密闭容器中充入物质的量浓度均为 0.1mol/L的CH4和 CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )
向密闭容器中充入物质的量浓度均为 0.1mol/L的CH4和 CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )
 向密闭容器中充入物质的量浓度均为 0.1mol/L的CH4和 CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )
向密闭容器中充入物质的量浓度均为 0.1mol/L的CH4和 CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )| A. | 平衡时CO与H2的物质的量比为1:1 | |
| B. | p1、p2、p3、p4由小到大的顺序为p1<p2<p3<p4 | |
| C. | 1100℃,p4条件下,该反应10 min时达到平衡点X,则ν(CO2)=0.008 mol•L-1•min-1 | |
| D. | 随着温度升高,该反应的平衡常数减小 |
10.某元素质量数51,中子数28,其基态原子未成对电子数为( )
| A. | 4 | B. | 1 | C. | 2 | D. | 3 |
20. BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )
BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )
 BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )
BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )| A. | 共价键 | B. | 离子键 | C. | 配位键 | D. | 范德华力 |
7.下列关于可逆反应的叙述不正确的是( )
| A. | 某可逆反应达平衡状态时反应物和生成物共存 | |
| B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2+O2与2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O互为可逆反应 | |
| C. | 对于可逆反应,加入催化剂可使正逆反应速率均增大 | |
| D. | 提高可逆反应的限度可增加产量,从而提高经济效益 |