题目内容
【题目】用惰性电极电极500mlKCl和Cu(NO3)2组成的混合溶液,一段时间后两极都得到22.4L(标准状况下)气体,电解后将溶液混合均匀后呈中性,则此溶液中NO3-的物质的浓度为
A. 2mol·L-1B. 1.2mol·L-1C. 4mol·L-1D. 1mol·L-1 .
【答案】A
【解析】
惰性电极电解KCl和CuSO4混合液,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,阳极发生2Cl--2e-=Cl2↑、40H--4e-═2H2O+O2↑,结合两极均得到22.4L气体(STP),说明阴极两个反应都发生了,阳极也是,根据电子守恒分析解答。
惰性电极电解KCl和CuSO4混合液,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,阳极发生2Cl--2e-=Cl2↑、40H--4e-═2H2O+O2↑,电解后将溶液混合均匀后呈中性,说明开始是电解氯化铜,且两极生成铜与氯气的物质的量相同;结合两极均得到22.4L气体(STP),说明阴极两个反应都发生了,阳极也是,阳极生成氯气和氧气共1mol,阴极生成铜和1mol氢气,设生成铜xmol,据电子守恒2x+2=2x+4×(1-x),x=0.5mol,溶液中NO3-的物质的量为1mol,NO3-的物质的量浓度为![]() =2mol·L-1,故选A。
=2mol·L-1,故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ![]() 探究1:验证同周期X、Y、Z三种元素金属性递变规律
探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Y剧烈 |
2、各取1.0g的金属Z和金属Y形状相同,分别加入到5mL 1.0mol/L盐酸中。 | 金属Y与盐酸反应比金属Z剧烈 |
(1)通过实验验证三种元素金属性由强到弱是_______________________,
(2)下列判断正确的是______
A.原子序数:![]()
![]() 原子的最外层电子数
原子的最外层电子数![]()
C.原子半径:X>Y>Z D. Z的最高价氧化物对应水化物的碱性最强
Ⅱ![]() 探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
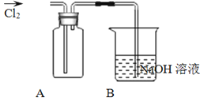
![]() 装置A中盛放的试剂是______
装置A中盛放的试剂是______![]() 填选项
填选项![]()
A.![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
B中反应的离子方程式是__________________________________________________。
![]() 下列不能用于验证氯元素比硫元素非金属性强的依据为______
下列不能用于验证氯元素比硫元素非金属性强的依据为______![]() 填选项
填选项![]()
A.HCl酸性比![]() 强 B.HClO氧化性比
强 B.HClO氧化性比![]() 强
强
C.HClO3酸性比![]() 强 D.铁与
强 D.铁与![]() 反应生成
反应生成![]() ,而硫与铁反应生成FeS
,而硫与铁反应生成FeS
![]() 若要验证非金属性:
若要验证非金属性:![]() ,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液______的现象,即可证明。用原子结构理论解释非金属性
,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液______的现象,即可证明。用原子结构理论解释非金属性![]() 的原因:同主族元素从上到下,____________________。
的原因:同主族元素从上到下,____________________。