题目内容
【题目】反应 4NH3(g)+5O2(g) 4NO(g) +6H2O(g) ΔH= - a kJ·mol-l (a>0),一定条件下在容积为5L的密闭容器中投入1 mol NH3 和 1mol O2,2min 末 NO 的物质的量增加了 0.4 mol,下列说法正确的是( )
A.2min时反应放出的热量等于 0.l a kJ
B.用氧气表示2min 内的平均反应速率:v(O2)=0.25 mol·L-1·min-1
C.2min内,NH3 的转化率小于O2的转化率
D.2min末,c(H2O)=0.6 mol·L-1
【答案】AC
【解析】
A.由反应式知,生成4molNO,放热a kJ ,2min时生成0.4 molNO,则反应放热0.l a kJ,A正确;
B.用氧气表示2min 内的平均反应速率:v(O2)=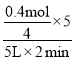 =0.05 mol·L-1·min-1,B不正确;
=0.05 mol·L-1·min-1,B不正确;
C.2min内,NH3 的转化率(40%)小于O2的转化率(50%),C正确;
D.2min末,c(H2O)=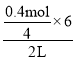 =0.3 mol·L-1,D不正确;
=0.3 mol·L-1,D不正确;
故选AC。

练习册系列答案
相关题目