题目内容
(1)在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ?mo1—1、285.8kJ?mo1—1和393.5kJ?mo1—1,则反应C(s)+2H2(g)=CH4(g)的反应热ΔH= 。
(2)已知:2H2(g)+O2(g)=2H2O(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2CO(g)+O2(g)=2CO2(g) ΔH3
①液态水转化为气态水的热化学方程式为 。
②CO和H2分别燃烧生成CO2 (g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是 。
(2)已知:2H2(g)+O2(g)=2H2O(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2CO(g)+O2(g)=2CO2(g) ΔH3
①液态水转化为气态水的热化学方程式为 。
②CO和H2分别燃烧生成CO2 (g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是 。
(6分)每空2分。
(1)—74.8kJ?mol—1
(2)①H2O(l)=H2O(g) ΔH=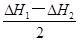
②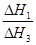
(1)—74.8kJ?mol—1
(2)①H2O(l)=H2O(g) ΔH=
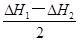
②
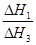
试题分析:(1)①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=—890.3kJ?mo1—1,②H2(g)+1/2O2(g)=H2O(l) ΔH=—285.8kJ?mo1—1,③C(s)+O2(g)=CO2(g) ΔH=—393.5kJ?mo1—1,根据盖斯定律,由③+②×2—①可得:C(s)+2H2(g)=CH4(g) ΔH=—74.8kJ?mol—1;(2)根据盖斯定律,由①—②可得:2H2O(l)=2H2O(g) ΔH=ΔH2—ΔH1,则H2O(l)=H2O(g) ΔH=(ΔH2—ΔH1)/2;设CO和H2分别为xmol、ymol,则CO放出热量为—ΔH3×xmol/2,H2放出热量为—ΔH1×ymol/2,因此—ΔH3×xmol/2=—ΔH1×ymol/2,则x/y=ΔH1/ΔH3。

练习册系列答案
相关题目

 2NH3(g)的特点,在给出的坐标图2中,画出其在1 MPa和10 MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
2NH3(g)的特点,在给出的坐标图2中,画出其在1 MPa和10 MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。

 CH4(g)+2H2O(g) ΔH<0
CH4(g)+2H2O(g) ΔH<0
 H2(g)+
H2(g)+ CH3OH ( g ) △H=-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H=-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。

 CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1,试写出由
CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1,试写出由