题目内容
键能是指断开1mol共价键吸收的能量或形成1mol共价键放出的能量,已知H-H键能为436kJ/mol,H-Cl键能为431kJ/mol, H2(g)+
H2(g)+ Cl2(g)=HCl(g) △H=-akJ/mol则Cl-Cl键能为
Cl2(g)=HCl(g) △H=-akJ/mol则Cl-Cl键能为
 H2(g)+
H2(g)+ Cl2(g)=HCl(g) △H=-akJ/mol则Cl-Cl键能为
Cl2(g)=HCl(g) △H=-akJ/mol则Cl-Cl键能为| A.(2a-426)kJ/mol | B.(426-a)kJ/mol |
| C.(426-2a)kJ/mol | D.(426+a)kJ/mol |
C
试题分析:由于反应热=反应物总键能-生成物总键能,因此Cl-Cl键能=(2×431-436-2a)kJ/mol=(426-2a)kJ/mol,故C正确

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
 O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1 O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
 Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。 C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。



 ①
①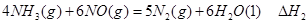 ②
② ③
③ 、
、 、
、 三者之间关系的表达式,
三者之间关系的表达式,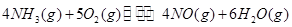
 =
=







 H= -221.0kJ/mmol
H= -221.0kJ/mmol
