题目内容
甲醇是一种重要的可再生能源,工业上可用CO和H2合成。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
若要求得CO(g)+2H2(g)=CH3OH(l)的△H,还需要知道反应(用化学方程式表示) 的焓变。
(2)在Cu2O/ZnO做催化剂的条件下,将CO(g)和H2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图。

根据题意回答下列问题:
①反应达到平衡时,平衡常数表达式K= ;
升高温度,K值 (填“增大”、“减小”
或“不变”)。
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
③若其它条件不变,对处于Z点的体系,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法正确的是 。
a.氢气的浓度与原平衡比减少 b.正、逆反应速率都加快
c.甲醇的物质的量增加 d.重新平衡时n(H2) /n(CH3OH)增大
④据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是: (写出相关的化学方程式并辅以必要的文字说明)。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
若要求得CO(g)+2H2(g)=CH3OH(l)的△H,还需要知道反应(用化学方程式表示) 的焓变。
(2)在Cu2O/ZnO做催化剂的条件下,将CO(g)和H2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图。

根据题意回答下列问题:
①反应达到平衡时,平衡常数表达式K= ;
升高温度,K值 (填“增大”、“减小”
或“不变”)。
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
③若其它条件不变,对处于Z点的体系,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法正确的是 。
a.氢气的浓度与原平衡比减少 b.正、逆反应速率都加快
c.甲醇的物质的量增加 d.重新平衡时n(H2) /n(CH3OH)增大
④据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是: (写出相关的化学方程式并辅以必要的文字说明)。
(1)2H2(g)+O2(g)=2H2O(l)(只要写对反应式即给1分。没配平扣1分,没标明状态扣1分,若二者都存在只扣1分。)
(2)①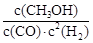 ; 减小。②0.2mol·L—1·s—1(没有单位或错扣1分)。③bc(各1分。填错一个倒扣1分,不出现负分。)。
; 减小。②0.2mol·L—1·s—1(没有单位或错扣1分)。③bc(各1分。填错一个倒扣1分,不出现负分。)。
④Cu2O+CO 2Cu+CO2,体系中有CO2可以抑制Cu2O被还原。(3分。化学方程式给1分,文字说明給2分。若化学方程式用可逆号,文字说明只要从化学平衡角度回答都给分。若说明CO2与Cu反应生成Cu2O也给分。)
2Cu+CO2,体系中有CO2可以抑制Cu2O被还原。(3分。化学方程式给1分,文字说明給2分。若化学方程式用可逆号,文字说明只要从化学平衡角度回答都给分。若说明CO2与Cu反应生成Cu2O也给分。)
(2)①
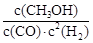 ; 减小。②0.2mol·L—1·s—1(没有单位或错扣1分)。③bc(各1分。填错一个倒扣1分,不出现负分。)。
; 减小。②0.2mol·L—1·s—1(没有单位或错扣1分)。③bc(各1分。填错一个倒扣1分,不出现负分。)。④Cu2O+CO
 2Cu+CO2,体系中有CO2可以抑制Cu2O被还原。(3分。化学方程式给1分,文字说明給2分。若化学方程式用可逆号,文字说明只要从化学平衡角度回答都给分。若说明CO2与Cu反应生成Cu2O也给分。)
2Cu+CO2,体系中有CO2可以抑制Cu2O被还原。(3分。化学方程式给1分,文字说明給2分。若化学方程式用可逆号,文字说明只要从化学平衡角度回答都给分。若说明CO2与Cu反应生成Cu2O也给分。)试题分析:(1)所求反应中有H2存在,CO2和H2O都是中间产物,结合盖斯定律,可推得还需要的反应为2H2(g)+O2(g)=2H2O(l)的焓变;
(2)①根据反应
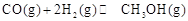 ,其平衡常数表达式
,其平衡常数表达式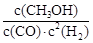 ,结合图像,可知升高温度,甲醇含量降低,平衡向逆反应方向移动,说明该反应是放热反应,故升高温度,K值减小;
,结合图像,可知升高温度,甲醇含量降低,平衡向逆反应方向移动,说明该反应是放热反应,故升高温度,K值减小;②在500℃,从反应开始到平衡,甲醇增加了0.4 mol,H2消耗了0.8 mol,则氢气的平均反应速率v(H2)=
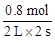 =0.2 mol·L—1·s—1;
=0.2 mol·L—1·s—1;③Z点处于平衡状态,将体积压缩至原来的1/2,相当于加压了,平衡正向移动,依次进行解答;
a、各物质的浓度均比原来增大了,错误;
b、浓度增大导致正、逆反应速率都加快,正确;
c、因平衡正向移动,甲醇的物质的量增加,正确;
d、因平衡正向移动,氢气减少,甲醇增加,所以n(H2) /n(CH3OH)将减小,错误;
④二氧化碳有利于抑制反应 Cu2O+CO
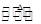 2Cu+CO2向正反应方向移动,维持Cu2O的量不变,。
2Cu+CO2向正反应方向移动,维持Cu2O的量不变,。
练习册系列答案
相关题目
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:


 N2+2CO2,则该反应的化学平衡常数表达式K=________。
N2+2CO2,则该反应的化学平衡常数表达式K=________。
 2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。
2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。
 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
 2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1