题目内容
17.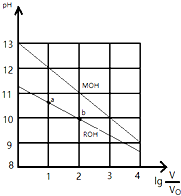 25℃时,浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示:
25℃时,浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示:(1)MOH的碱性>(填>、<或=)ROH的碱性;
(2)ROH的电离度:a点<(填>、<或=)b点;
(3)当lg$\frac{V}{{V}_{0}}$=2时,MOH和ROH两种溶液中,水电离的c(OH-)的比值是1:10;
(4)当lg$\frac{V}{{V}_{0}}$=3时,若MOH和ROH两溶液同时升高温度10℃,则$\frac{c({M}^{+})}{c({R}^{+})}$减小(填“增大”、“减小”或“不变”)
分析 (1)相同浓度的一元碱,碱的pH越大其碱性越强;
(2)弱电解质在水溶液中随着浓度的减小其电离程度增大;
(3)当lg$\frac{V}{{V}_{0}}$=2时,MOH溶液的pH为11,ROH溶液的pH为10,溶液中水电离的c(OH-)=c(H+);
(4)MOH的碱性强于ROH的碱性,当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,促进弱电解质电离.
解答 解:(1)相同浓度的一元碱,碱的pH越大其碱性越强,根据图知,未加水时,相同浓度条件下,MOH的pH大于ROH的pH,说明MOH的电离程度大于ROH,则MOH的碱性强于ROH的碱性,
故答案为:>;
(2)由图示可以看出ROH为弱碱,弱电解质在水溶液中随着浓度的减小其电离程度增大,b点溶液体积大于a点,所以b点浓度小于a点,则ROH电离程度:b>a,
故答案为:<;
(3)当lg$\frac{V}{{V}_{0}}$=2时,MOH溶液的pH为11,ROH溶液的pH为10,溶液中水电离的c(OH-)=c(H+),所以MOH和ROH两种溶液中,水电离的c(OH-)分别为10-11mol/L、10-10mol/L,则水电离的c(OH-)的比值是1:10,
故答案为:1:10;
(4)碱性MOH>ROH,当lg$\frac{V}{{V}_{0}}$=3时,由于ROH是弱电解质,升高温度能促进ROH的电离,则$\frac{c({M}^{+})}{c({R}^{+})}$减小,故答案为:减小.
点评 本题考查弱电解质在水溶液中电离平衡,题目难度中等,明确弱电解质电离特点、弱电解质电离程度与溶液浓度关系等知识点是解本题关键.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
8.常温下在水中加入下列物质,不会破坏水的电离平衡的是( )
| A. | 通入HCl 气体 | B. | 加入NaOH 固体 | C. | 加入蔗糖 | D. | 加入金属钠 |
5.在一个恒容密闭容器中盛有22g气体X (X的摩尔质量为44g•mol-1),容器内压强2×104Pa.若在相同温度下继续把气体X充入容器,使容器内压强增大到5×104Pa,则这时容器内气体X的分子数约为:(注:恒温恒容下,气体的压强之比等于气体的分子数之比)( )
| A. | 3.3×1023 | B. | 3.3×1024 | C. | 7.5×1023 | D. | 7.5×1022 |
12.已知常温下,0.1mol•L?1CH3COONH4溶液呈中性.下列有关叙述正确的是( )
| A. | 该溶液可由等体积、浓度均为0.1mol•L?1的醋酸和氨水反应得到 | |
| B. | CH3COONH4加入纯水中,水的电离程度不变 | |
| C. | 常温下,电离常数K(CH3COOH)=K(NH3•H2O) | |
| D. | 该溶液中c(CH3COO?)大于同浓度CH3COONa溶液中的c(CH3COO?) |
2.向27.2Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2.在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g.下列说法正确的是( )
| A. | Cu与Cu2O 的物质的量之比为1:2 | |
| B. | 产生的NO的体积为4.48L | |
| C. | 硝酸的物质的量浓度为2.6mol/L | |
| D. | Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
9.如图是a、b两种固体物质的溶解度曲线,下列说法中,正确的是( )


| A. | a的溶解度大于b的溶解度 | |
| B. | 在t℃时,a、b的饱和溶液中溶质的物质的量浓度相同 | |
| C. | 升高温度时,a、b溶解度均增大 | |
| D. | 在t℃时,将a、b的饱和溶液升温后,溶质的质量分数:a>b |
6.下列电离方程式书写正确的是( )
| A. | 把CaO放入水中:CaO=Ca2++O2- | |
| B. | 加热NaHSO4至熔化:NaHSO4=Na2++H++SO42- | |
| C. | 把Mg(OH)2放入水中:Mg(OH)2=Mg2++2OH- | |
| D. | 把NaCl放入水中:NaCl=Na++Cl- |
5. A、B、C三种短周期元素在周期表中的相对位置如图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )
A、B、C三种短周期元素在周期表中的相对位置如图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )
 A、B、C三种短周期元素在周期表中的相对位置如图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )
A、B、C三种短周期元素在周期表中的相对位置如图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )| A. | B与C均不存在同素异形体 | B. | X一定是酸性氧化物 | ||
| C. | B的氢化物比A、C的氢化物稳定 | D. | A与B形成的化合物X有3种 |
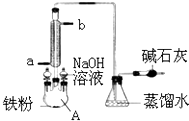 如图是实验室制溴苯的装置图:请回答:
如图是实验室制溴苯的装置图:请回答: