题目内容
6.下列电离方程式书写正确的是( )| A. | 把CaO放入水中:CaO=Ca2++O2- | |
| B. | 加热NaHSO4至熔化:NaHSO4=Na2++H++SO42- | |
| C. | 把Mg(OH)2放入水中:Mg(OH)2=Mg2++2OH- | |
| D. | 把NaCl放入水中:NaCl=Na++Cl- |
分析 强电解质是指强酸、强碱和大多数盐.强电解质完全电离,溶质微粒在溶液中以离子形式存在,书写电离方程式用等号,弱电解质是指弱酸、弱碱和水.弱电解质只有少部分电离,溶质微粒在溶液中多数以分子形式存在,少数以离子形式存在,书写电离方程式用可逆号,多元弱酸分步电离,多元弱碱一步写到位.
解答 解:A.把CaO放入水中,氧化钙立即和水反应生成氢氧化钙,无氧化钙的电离,故A错误;
B.硫酸氢钠熔融完全电离生成钠离子、硫酸氢根离子,NaHSO4=Na++HSO4-,故B错误;
C.氢氧化镁是弱电解质,电离方程式为Mg(OH)2?Mg2++2OH-,故C错误;
D.NaCl为强电解质,电离方程式为NaCl=Na++Cl-,故D正确;
故选D.
点评 本题考查电解质电离方程式的书写,题目难度较小.掌握正确书写电离方程式的方法,并会正确判断正误是解答关键,注意把CaO放入水中,无氧化钙的电离,注意易错点:1多元弱酸分步电离,以第一步为主;2多元弱酸的酸式根离子不能拆;3多元弱碱虽然一步写到位但因为是弱电解质所以仍然用可逆号.

练习册系列答案
相关题目
16.常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)冰比硫化氢热稳定性高的原因是O-H键的键长小于H-S键的键长.
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如表所示:
则元素Y第一电离能大于X的原因是Mg为3s2构型,完全充满状态,是一种稳定结构;
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐.
①写出亚铁离子的核外电子排布式[Ar]3d6;
②已知CN-与 N2结构相似,1mol CN-中π键数目为2NA.
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)冰比硫化氢热稳定性高的原因是O-H键的键长小于H-S键的键长.
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐.
①写出亚铁离子的核外电子排布式[Ar]3d6;
②已知CN-与 N2结构相似,1mol CN-中π键数目为2NA.
14.下列实验能达到预期目的是( )
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸;②用NaOH溶液除去苯中的少量苯酚;③用饱和NaHCO3溶液除去CO2中的少量SO2;④用加热的方法提取NH4Cl固体中混有的少量碘;⑤用酒精萃取碘水中的碘.
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸;②用NaOH溶液除去苯中的少量苯酚;③用饱和NaHCO3溶液除去CO2中的少量SO2;④用加热的方法提取NH4Cl固体中混有的少量碘;⑤用酒精萃取碘水中的碘.
| A. | ①⑤ | B. | ①②④⑤ | C. | ②③ | D. | ②③⑤ |
11.现有1L 2mol•L-1的盐酸与100g NaOH样品配制成的溶液(杂质不与盐酸反应),则该样品中Na0H的质量分数是( )
| A. | 80% | B. | 60% | C. | 40% | D. | 20% |
18.天平两边托盘上各放等质量的烧杯,烧杯中盛放等体积、等浓度的稀硫酸,若向两个烧杯中分别放人一块锌片和一块铁片,充分反应后,金属均有剩余且天平仍保持平衡,则最初锌和铁的物质的量之比为( )
| A. | 1:1 | B. | 54:63 | C. | 56:65 | D. | 65:56 |
15.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1 CH3COONa溶液与0.1mol•L-1 CH3COOH溶液等体积混合(pH=4.75):c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| C. | 0.1mol•L-1 CH3COONa溶液与0.1mol•L-1 HCl溶液混合至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)>c(CH3COO-) | |
| D. | 0.1mol•L-1 Na2CO3溶液与0.1mol•L-1 NaHCO3溶液等体积混合:c(HCO3)+2c(H+)+3c(H2CO3)=c(CO32-)+2c(OH-) |
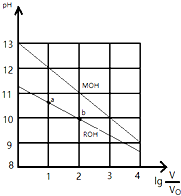 25℃时,浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示:
25℃时,浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示: