题目内容
8.常温下在水中加入下列物质,不会破坏水的电离平衡的是( )| A. | 通入HCl 气体 | B. | 加入NaOH 固体 | C. | 加入蔗糖 | D. | 加入金属钠 |
分析 水的电离方程式为H2O?H++OH-,加入的物质或离子能影响水电离平衡的移动,则破坏水的电离.
解答 解:A.通入HCl气体,HCl在水中电离出氢离子,导致氢离子浓度增大,平衡向逆反应方向移动,则破坏水的电离,故A错误;
B.加入氢氧化钠固体,在水中电离出的氢氧根抑制水的电离,破坏水的电离平衡,故B错误;
C.加入蔗糖,蔗糖在水中不能电离,对水的电离平衡无影响,则不破坏水的电离,故C正确;
D.加入金属钠,Na与水电离的氢离子反应生成氢气,溶液中氢离子浓度减小,水的电离平衡正移,氢氧根离子浓度增大,则破坏水的电离,故D错误;
故选C.
点评 本题考查了水的电离,酸或碱能抑制水的电离,含有弱根离子的盐能促进水的电离,根据溶液中氢离子和氢氧根离子浓度是否变化来确定是否破坏水的电离,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用.
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是SiO2+2NaOH═Na2SiO3+H2O(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是D.
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
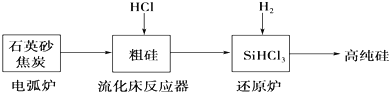
①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
③SiHCl3极易水解,其完全水解的化学方程式为SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是SiO2+2NaOH═Na2SiO3+H2O(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是D.
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2 355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
16.常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)冰比硫化氢热稳定性高的原因是O-H键的键长小于H-S键的键长.
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如表所示:
则元素Y第一电离能大于X的原因是Mg为3s2构型,完全充满状态,是一种稳定结构;
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐.
①写出亚铁离子的核外电子排布式[Ar]3d6;
②已知CN-与 N2结构相似,1mol CN-中π键数目为2NA.
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)冰比硫化氢热稳定性高的原因是O-H键的键长小于H-S键的键长.
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐.
①写出亚铁离子的核外电子排布式[Ar]3d6;
②已知CN-与 N2结构相似,1mol CN-中π键数目为2NA.
3.下列说法不正确的是( )
| A. | 二氧化氮会导致酸雨和光化学烟雾,危害较大 | |
| B. | 铝制品不宜用于盛放酸、碱溶液,不宜长时间盛放咸菜等腌制食品 | |
| C. | 人体中极少量的NO 会促进血管扩张,防止血管栓塞 | |
| D. | 利用铝热反应可实现工业制镁 |
13.已知室温时,0.1mol•L-1 某一元酸 HA的水溶液 pH=4,则下列叙述错误的是( )
| A. | NaA 溶液呈碱性 | |
| B. | 升高温度,HA 溶液的pH 增大 | |
| C. | HA 电离平衡常数约为1×10-7 | |
| D. | 将该溶液稀释100 倍后,pH 介于4 至6 之间 |
18.天平两边托盘上各放等质量的烧杯,烧杯中盛放等体积、等浓度的稀硫酸,若向两个烧杯中分别放人一块锌片和一块铁片,充分反应后,金属均有剩余且天平仍保持平衡,则最初锌和铁的物质的量之比为( )
| A. | 1:1 | B. | 54:63 | C. | 56:65 | D. | 65:56 |

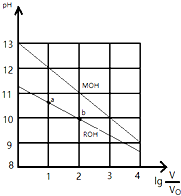 25℃时,浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示:
25℃时,浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示: