题目内容
【题目】合成氨及甲醇生产中微量的羰基硫(COS)也可引起催化剂中毒失活,常采用水解法进行羰基硫的脱除,反应原理为COS(g)+H2O(g)![]() CO2(g)+H2S(g)。
CO2(g)+H2S(g)。
回答下列问题:
(1)已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-18kJ·mol-1。若氢气还原法脱除羰基硫的热化学方程式为COS(g)+H2(g)
CO2(g)+H2(g) △H=-18kJ·mol-1。若氢气还原法脱除羰基硫的热化学方程式为COS(g)+H2(g)![]() CO(g)+H2S(g) △H=-17kJ·mol-1,则水解法脱除羰基硫对应的反应热△H=___。
CO(g)+H2S(g) △H=-17kJ·mol-1,则水解法脱除羰基硫对应的反应热△H=___。
(2)T℃时,向体积均为2L的甲、乙两个密闭容器中,分别投入2molCOS(g)和2molH2O(g),发生反应COS(g)+H2O(g)![]() CO2(g)+H2S(g),甲在恒压条件下达到平衡,乙在恒容条件下达到平衡。
CO2(g)+H2S(g),甲在恒压条件下达到平衡,乙在恒容条件下达到平衡。
①COS的平衡转化率:甲__乙(填“>”“<”或“=”),理由是__。
②下列情况能说明甲中反应达到平衡状态的是__(填选项字母)。
A.混合气体的平均摩尔质量不再发生变化
B.H2O和CO2的消耗速率相等
C.混合气体的总压保持不变
D.H2S和CO2的体积分数之比不再变化
③乙中反应开始时压强为p0,由反应开始至达到平衡状态用时5min,达到平衡时c(H2S)=0.2mol·L-1,用COS(g)的浓度变化表示的平均反应速率为__;在化学平衡体系中,用各气体物质的分压替代浓度求得的平衡常数Kp=__。
(3)某实验室对羰基硫水解催化技术进行研究,发现在实验条件下,仅改变温度,相同时间内羰基硫水解转化率的改变如图1所示,温度高于200°C羰基硫转化率减小,可能的原因为__(任写两条);若保持温度为250℃,仅改变水蒸气含量,相同时间内羰基硫水解转化率的改变如图2所示,该图所得结论与根据方程式理论分析所得结论__(填“是”或“否”)一致,造成此结果可能的原因为__。

【答案】35kJ·mol-1 = 反应是等体积反应,平衡时两个容器体积一样大,转化率相等 B 0.04 mol·L-1·min-1 0.0625 该反应是放热反应,升高温度,平衡逆向移动,转化率减小;温度升高,催化剂活性降低,转化率降低; 否 过量的水蒸汽在催化剂活性中心覆盖形成水膜,导致COS在活性中心吸附量减少,影响了催化剂内表面上的利用率,使得COS的转化率下降了
【解析】
⑴利用盖斯定律将两个方程式相加得到。
⑵①反应是等体积反应,平衡时两个容器体积一样大;②A. 混合气体的平均摩尔质量等于质量除以物质的量,质量不变,物质的量不变,因此混合气体的平均摩尔质量不变,当不再发生变化,不能说明达到平衡;B. H2O消耗速率相等,正向,CO2的消耗速率相等,逆向,两个不同方向,且速率之比等于计量数之比,因此能作为判断平衡的标志;C. 混合气体的总压始终不变,因此不能作为判断平衡的标志;D. H2S和CO2都为生成物,因此H2S和CO2体积分数之比始终不变,因此不能作为判断平衡的标志;③先计算达到平衡时Δc(COS),再计算COS(g)的平均反应速率;再建立三段式。计算用各气体物质的分压替代浓度求平衡常数。
⑶升高温度,平衡逆向移动,转化率减小;温度升高,催化剂活性降低,转化率降低;若保持温度为250℃,增加水蒸气量,平衡正向移动,COS消耗更多,转化率增大,如果过量的水蒸汽在催化剂活性中心覆盖形成水膜,影响了催化剂内表面上的利用率,使得COS的转化率下降了。
⑴将两个方程式相加得到COS(g) + H2O(g) ![]() CO2(g)+H2S(g) △H=18kJ·mol-1 + (17kJ·mol-1)= 35kJ·mol-1;故答案为:35kJ·mol-1。
CO2(g)+H2S(g) △H=18kJ·mol-1 + (17kJ·mol-1)= 35kJ·mol-1;故答案为:35kJ·mol-1。
⑵T℃时,向体积均为2L的甲、乙两个密闭容器中,分别投入2molCOS(g)和2molH2O(g),发生反应COS(g)+H2O(g)![]() CO2(g)+H2S(g),甲在恒压条件下达到平衡,乙在恒容条件下达到平衡。
CO2(g)+H2S(g),甲在恒压条件下达到平衡,乙在恒容条件下达到平衡。
①反应是等体积反应,平衡时两个容器体积一样大,两个容器COS的平衡转化率相等故答案为:=;反应是等体积反应,平衡时两个容器体积一样大,转化率相等。
②A. 混合气体的平均摩尔质量等于质量除以物质的量,质量不变,物质的量不变,因此混合气体的平均摩尔质量不变,当不再发生变化,不能说明达到平衡,故A不符合题意;B. H2O消耗速率相等,正向,CO2的消耗速率相等,逆向,两个不同方向,且速率之比等于计量数之比,因此能作为判断平衡的标志,故B符合题意;C. 混合气体的总压始终不变,因此不能作为判断平衡的标志,故C不符合题意;D. H2S和CO2都为生成物,因此H2S和CO2体积分数之比始终不变,因此不能作为判断平衡的标志,故D不符合题意;综上所述,答案为B。
③乙中反应开始时压强为p0,由反应开始至达到平衡状态用时5min,达到平衡时c(H2S)=0.2mol·L-1,则COS(g)的Δc(COS) =0.2mol·L-1, COS(g)的浓度变化表示的平均反应速率![]() ;
;
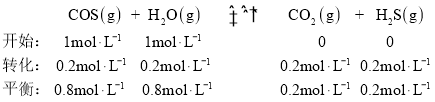
在化学平衡体系中,用各气体物质的分压替代浓度求得的平衡常数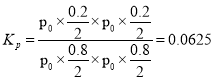 ;故答案为:0.04 mol·L-1·min-1;0.0625。
;故答案为:0.04 mol·L-1·min-1;0.0625。
⑶某实验室对羰基硫水解催化技术进行研究,发现在实验条件下,仅改变温度,相同时间内羰基硫水解转化率的改变如图1所示,温度高于200°C羰基硫转化率减小,可能的原因为该反应是放热反应,升高温度,平衡逆向移动,转化率减小;温度升高,催化剂活性降低,转化率降低;若保持温度为250℃,仅改变水蒸气含量,相同时间内羰基硫水解转化率的改变如图2所示,增加水蒸气量,平衡正向移动,COS消耗更多,转化率增大,因此该图所得结论与根据方程式理论分析所得结论不一致,造成此结果可能的原因为过量的水蒸汽在催化剂活性中心覆盖形成水膜,导致COS在活性中心吸附量减少,影响了催化剂内表面上的利用率,使得COS的转化率下降了;故答案为:该反应是放热反应,升高温度,平衡逆向移动,转化率减小;温度升高,催化剂活性降低,转化率降低;否;过量的水蒸汽在催化剂活性中心覆盖形成水膜,导致COS在活性中心吸附量减少,影响了催化剂内表面上的利用率,使得COS的转化率下降了。