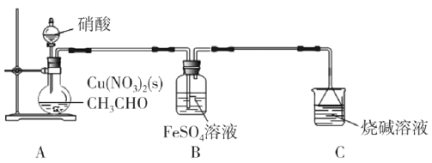
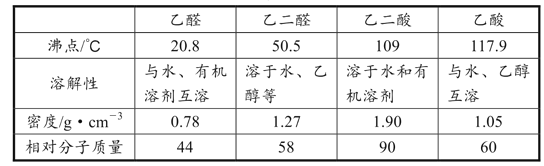
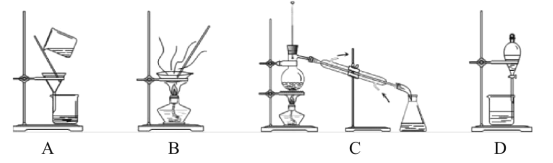
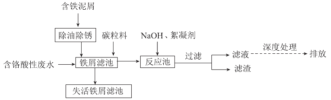
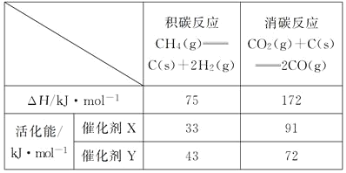
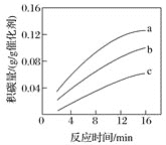
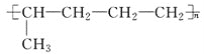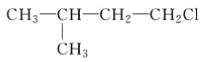题目内容
【题目】乙二酸俗称草酸,为二元酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数K1=5.0×10-2,K2=5.4×10-5;碳酸的电离平衡常数K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式:________________________________。
(2)25℃,物质的量浓度都为0.1 mol/L的Na2C2O4溶液的pH比Na2CO3溶液pH______________________(填“大”“小”或“相等”)。
(3)常温下将0.2 mol/L的KOH溶液10 mL与0.2 mol/L的草酸溶液10 mL混合,若混合溶液显酸性,则该溶液中所有离子浓度由大到小的顺序:____________________。
(4)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入1.0×10-3mol/L的草酸钾溶液20 mL,能否产生沉淀?________________(填“能”或“否”)。
(5)除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理,而后用盐酸溶解,其反应的离子方程式:______________________________;________________________________。
【答案】H2C2O4![]() HC2O4-+H+ HC2O4-
HC2O4-+H+ HC2O4-![]() C2O42-+H+ 小 c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) 否 CaSO4 + CO32-= CaCO3+ SO42- CaCO3+ 2H+= Ca2++ H2O + CO2↑
C2O42-+H+ 小 c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) 否 CaSO4 + CO32-= CaCO3+ SO42- CaCO3+ 2H+= Ca2++ H2O + CO2↑
【解析】
(1)草酸是二元弱酸,在水中部分电离,电离方程式是H2C2O4![]() HC2O4-+H+,HC2O4-
HC2O4-+H+,HC2O4-![]() C2O42-+H+;
C2O42-+H+;
(2)根据草酸与碳酸的电离常数判断,草酸的酸性强,根据越弱越水解规律,所以25℃,物质的量浓度都为0.1 mol/L的Na2C2O4溶液的水解程度小于Na2CO3溶液的水解程度,所以Na2C2O4溶液的pH比Na2CO3溶液pH小;
(3)常温下将0.2 mol/L的KOH溶液10 mL与0.2 mol/L的草酸溶液10 mL混合,得到的是草酸氢钾溶液,若混合溶液显酸性,说明HC2O4-的电离程度大于HC2O4-的水解程度,溶液中不水解的离子的浓度最大,所以所得溶液中离子浓度的关系是c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(4)根据草酸钙与碳酸钙的溶度积可知,碳酸钙的饱和溶液中,钙离子的浓度是5×10-5mol/L,向20 mL碳酸钙的饱和溶液中逐滴加入1.0×10-3mol/L的草酸钾溶液20 mL,则c(Ca2+)=2.5×10-5mol/L,c(C2O42-)=0.5×10-3mol/L,c(Ca2+)×c(C2O42-)=1.25×10-8<4.0×10-8,则不会产生草酸钙沉淀;
(5) 除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理,是因为硫酸钙微溶,加入碳酸钠后,硫酸钙逐渐转化为更难溶的碳酸钙沉淀,而后用盐酸溶解,碳酸钙与稀盐酸反应生成易溶的氯化钙,从而除去水垢,离子方程式是CaSO4 +CO32-=CaCO3+SO42-;CaCO3+2H+=Ca2++H2O+CO2↑。