题目内容
【题目】下列说法正确的是( )
A. 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B. 乙烯与溴加成反应的产物为溴乙烷
C. 1 mol苯恰好与3 mol氢气完全加成,说明苯分子中有三个碳碳双键
D. 当n=7,主链上有5个碳原子的烷烃共有5种
【答案】D
【解析】
A.烷烃的通式为CnH2n+2,C元素的质量分数为![]() =
=![]() ,则随n值增大,碳元素的质量百分含量逐渐增大,故A错误;
,则随n值增大,碳元素的质量百分含量逐渐增大,故A错误;
B.乙烯中含碳碳双键,可与溴水发生加成反应生成1,2-二溴乙烷,故B错误;
C.苯分子中不存在碳碳双键,故C错误;
D.n=7,主链上有5个碳原子的烷烃,支链为2个甲基或1个乙基,符合条件的有(CH3)3CCH2CH2CH3、CH3CH2C(CH3)2CH2CH3、CH3CH2CH(CH2CH3)CH2CH3、(CH3)2CHCH2CH(CH3)2、(CH3)2CHCH(CH3)CH2CH3,共5种,故D正确;
答案选D。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】乙苯(![]() )、苯乙烯(
)、苯乙烯(![]() )均是重要的有机溶剂和工业原料。
)均是重要的有机溶剂和工业原料。
已知:①![]() (g)+HCl(g)
(g)+HCl(g)![]()
![]() (g) △H1= 54 kJmol1
(g) △H1= 54 kJmol1
②H2(g)+Cl2(g)=2HCl(g) △H2=185 kJmol1
③![]() (g)+Cl2(g)
(g)+Cl2(g)![]()
![]() (g)+HCl(g) △H3=118kJmol1
(g)+HCl(g) △H3=118kJmol1
④相关化学键的键能数据如表所示:
化学键 | CH | CC | C=C | CCl | HCl |
键能/(kJmol1) | 412 | 348 | x | 341 | 432 |
请回答:
(1)x=___;
(2)![]() (g)+H2(g)
(g)+H2(g)![]() (g) △H4
(g) △H4
①△H4=___。
②上述反应中,![]() 的平衡转化率α与温度(T)和压强(P)的关系如图所示。则:
的平衡转化率α与温度(T)和压强(P)的关系如图所示。则:
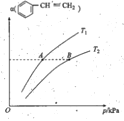
I.A、B两点的平衡常数:K(A)___K(B)(填“大于”、“小于”或“等于”)。
II.A、B两点的正反应速率:v(A)___v(B)(填“大于”、“小于”或“等于”)。
(3)工业中用乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)。向体积为VL的恒容容器中充入amol乙苯,压强为1×106Pa,在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①乙苯的平衡转化率为___;
②此温度下乙苯催化脱氢的方法制取苯乙烯的平衡常数Kp=___Pa;
③实际生产的反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比对乙苯转化率的影响可用图表示。[M=n(H2O)/n(乙苯]
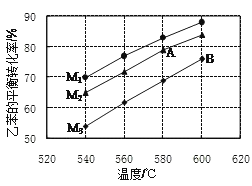
a.图中投料比(M1、M2、M3)的大小顺序为___;
b.随着反应的进行,催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是___(用化学方程式表示)。
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
实验方案 | 现象 | 结论 |
步骤1:取4mL①__________ mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
步骤2:取4mL②__________mol/LFeSO4 溶液向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
查阅资料:
已知①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③___________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入 3mL0.5mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因___________________________________。
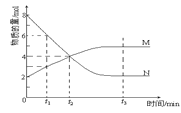
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①反应Ⅰ是一个不可逆反应,设计实验方案加以证明_____________________________。
②请用化学平衡移动原理解释溶液由棕色变为黄色的原因_____________________________。