ћвƒњƒЏ»Ё
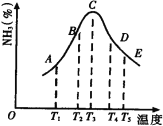
°Њћвƒњ°њA°ҐB°ҐC°ҐD°ҐE «÷№∆Џ±н÷–«∞Ћƒ÷№∆Џµƒ‘™ЋЎ£ђ∆д”–єЎ–‘÷ їтљбєє–≈ѕҐ»зѕ¬±н£Ї
‘™ЋЎ | ”–єЎ–‘÷ їтљбєє–≈ѕҐ |
A | ЄЇґюЉџµƒA‘™ЋЎµƒ«вїѓќп‘ЏЌ®≥£„іњцѕ¬ «“ї÷÷“Їће£ђ∆д÷–Aµƒ÷ ЅњЈ÷ эќ™88.9% |
B | B‘≠„”µ√µљ“їЄцµз„”Їу3pємµј»Ђ≥д¬ъ |
C | C‘≠„”µƒpємµј∞л≥д¬ъ£ђЋьµƒ∆шћђ«вїѓќпƒ№”л∆д„оЄяЉџ—хїѓќпµƒЋЃїѓќпЈі”¶…ъ≥…“ї÷÷≥£Љыµƒ—ќX |
D | D‘™ЋЎµƒ„оЄяїѓЇѕЉџ”л„оµЌїѓЇѕЉџµƒіъ эЇЌќ™Ѕг£ђ∆д„оЄяЉџ—хїѓќпЋЃїѓќпµƒЋб–‘ќ™Ќђ÷ч„е„о«њ |
E | E‘™ЋЎµƒЇЋµзЇ… эµ»”ЏA‘≠„”µƒЇЋµзЇ… эЇЌB‘™ЋЎ«вїѓќпµƒЇЋµзЇ… э÷ЃЇЌ |
£®1£©‘™ЋЎY «Cѕ¬“ї÷№∆ЏЌђ÷ч„е‘™ЋЎ£ђ±»љѕB°ҐY‘™ЋЎµƒµЏ“їµзјлƒ№I1£®B£© I1£®Y£©£®ћо°∞£Њ°±°∞£љ°±їт°∞£Љ°±£©£ї
£®2£©—ќXµƒЋЃ»№“Ї≥ £®ћо°∞Ћб–‘°±°∞Љо–‘°±їт°∞÷––‘°±£© £ђ‘≠“т________________£®”√јл„”Јљ≥ћ љ±н Њ£©£ї
£®3£©E‘™ЋЎ‘≠„”µƒЇЋЌвµз„”≈≈≤Љ љќ™_____________£ђ‘Џ÷№∆Џ±н÷–µƒќї÷√______________£ї
£®4£©Cµ•÷ Ј÷„”÷–¶“ЉьЇЌ¶–ЉьµƒЄц э±»ќ™ £ђCµƒ«вїѓќп‘ЏЌђ„е‘™ЋЎµƒ«вїѓќп÷–Ј–µг≥цѕ÷Јі≥££ђ∆д‘≠“т «____________________________________________£ї
£®5£©”√Єяƒ№…дѕя’’…д“ЇћђH2A ±£ђ“їЄцH2AЈ÷„”ƒ№ ЌЈ≈≥ц“їЄцµз„”£ђЌђ ±≤ъ…ъ“ї÷÷Њя”–љѕ«њ—хїѓ–‘µƒ—фјл„”£ђ ‘–і≥цЄ√—фјл„”µƒµз„” љ£Ї £ђ–і≥цЄ√—фјл„””лЅтµƒ«вїѓќпµƒЋЃ»№“ЇЈі”¶µƒјл„”Јљ≥ћ љ£Ї_________________________________________°£
°Њір∞Є°њ£®1£©£Њ
£®2£©Ћб–‘ NH4++H2O![]() NH3°§H2O+H+
NH3°§H2O+H+
£®3£© 1s22s22p63s23p63d64s2 їт[Ar]3d64s2µЏЋƒ÷№∆ЏҐш„е
£®4£©1°√2 NH3Ј÷„”Љдіж‘Џ«вЉь
£®5£©![]() 2H2O£Ђ£ЂH2S£љS°э£Ђ2H2O£Ђ2H£Ђ
2H2O£Ђ£ЂH2S£љS°э£Ђ2H2O£Ђ2H£Ђ
°Њљвќц°њ ‘ћвЈ÷ќц£ЇЄЇґюЉџµƒA‘™ЋЎµƒ«вїѓќп‘ЏЌ®≥£„іњцѕ¬ «“ї÷÷“Їће£ђ∆д÷–Aµƒ÷ ЅњЈ÷ эќ™88.9%£ђ’∆ќ’A «O£їB‘≠„”µ√µљ“їЄцµз„”Їу3pємµј»Ђ≥д¬ъ£ђ‘тB «Cl£їC‘≠„”µƒpємµј∞л≥д¬ъ£ђЋьµƒ∆шћђ«вїѓќпƒ№”л∆д„оЄяЉџ—хїѓќпµƒЋЃїѓќпЈі”¶…ъ≥…“ї÷÷≥£Љыµƒ—ќX£ђ‘тC «N£ђX «ѕхЋбпІ£їD‘™ЋЎµƒ„оЄяїѓЇѕЉџ”л„оµЌїѓЇѕЉџµƒіъ эЇЌќ™Ѕг£ђ∆д„оЄяЉџ—хїѓќпЋЃїѓќпµƒЋб–‘ќ™Ќђ÷ч„е„о«њ£ђ ф”ЏD «C‘™ЋЎ£їE‘™ЋЎµƒЇЋµзЇ… эµ»”ЏA‘≠„”µƒЇЋµзЇ… эЇЌB‘™ЋЎ«вїѓќпµƒЇЋµзЇ… э÷ЃЇЌ£ђ“тіЋE «Fe°£
£®1£©Yќ™P£ђPµƒЉџµз„”≈≈≤Љќ™3s23p3£ђќ™∞л≥д¬ъ„іћђ£ђµЏ“їµзјлƒ№–°”ЏCl°£
£®2£©пІЄщЋЃљв»№“Їѕ‘Ћб–‘£ђЋЃљвЈљ≥ћ љќ™NH4++H2O![]() NH3°§H2O+H+°£
NH3°§H2O+H+°£
£®3£©ћъµƒ‘≠„”–т э «26£ђЇЋЌвµз„”≈≈≤Љ љќ™1s22s22p63s23p63d64s2 їт[Ar]3d64s2£ђќї”Џ‘™ЋЎ÷№∆Џ±нµƒµЏЋƒ÷№∆ЏµЏҐш„е£ђ
£®4£©N2Ј÷„”Їђµ™µ™»эЉь,¶“ЉьЇЌ¶–ЉьµƒЄц э±»ќ™1°√2£ї”…”ЏЈ÷„”Љдіж‘Џ«вЉь£ђє є∆дЈ–µг≥цѕ÷Јі≥£°£
£®5£©H2O ЌЈ≈≥ц“їЄцµз„”…ъ≥…H2O+£ђµз„” љќ™![]() £ї∆д÷–—х‘™ЋЎќ™-1Љџ,Њя”–«њ—хїѓ–‘£ђ”лЅтµƒ«вїѓќпµƒЋЃ»№“ЇЈі”¶µƒјл„”Јљ≥ћ љќ™2H2O£Ђ£ЂH2S£љS°э£Ђ2H2O£Ђ2H£Ђ°£
£ї∆д÷–—х‘™ЋЎќ™-1Љџ,Њя”–«њ—хїѓ–‘£ђ”лЅтµƒ«вїѓќпµƒЋЃ»№“ЇЈі”¶µƒјл„”Јљ≥ћ љќ™2H2O£Ђ£ЂH2S£љS°э£Ђ2H2O£Ђ2H£Ђ°£

°Њћвƒњ°њ”––©є≈ќƒїт—и”п∞ьЇђЅЋЈбЄїµƒїѓ—І÷™ ґ£ђѕ¬Ѕ–љв Ќ≤ї’э»Јµƒ «£® £©
—°ѕо | є≈ќƒїт—и”п | їѓ—Іљв Ќ |
A | »’’’ѕг¬ѓ…ъ„ѕ—ћ | µвµƒ…эї™ |
B | “‘‘ш«аЌњћъ£ђћъ≥а…Ђ»зЌ≠ | ÷√їїЈі”¶ |
C | ÷уґє»ЉґєЁљ | їѓ—Іƒ№„™їѓќ™»»ƒ№ |
D | ј„”кЈ „ѓЉЏ | „‘»їєћµ™ |