题目内容
【题目】)常温下钛的化学活性很小,在较高温度下可与多种物质反应。
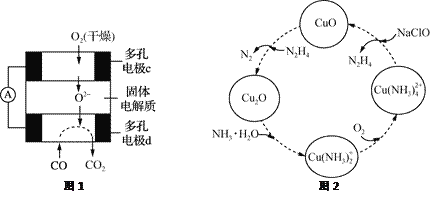
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:

① 沸腾氯化炉中发生的主要反应为:_____________。
② 己知:Ti (s)+2Cl2(g)=TiCl4(l) △H=akJ/mol;
2Na(s)+Cl2(g)=2NaCl(s) △H=bkJ/mol;
Na(s) = Na (l) △H=ckJ/mol
则TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s) △H=________kJ/mol
③ TiCl4遇水强烈水解,写出其水解的化学方程式________。
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示。二氧化钛电极连接电源_____极,该极电极反应为__________。

(3)若以二甲醚(CH3OCH3)、空气、氢氧化钾溶液为原料,多孔石墨为电极构成的燃料电池提供上述电解的电源,则该电池工作时负极的电极反应式为____________。
【答案】 TiO2+2C+2Cl2![]() TiCl4+2CO 2b-4c-a TiCl4+4H2O=Ti(OH)4↓+4HCl↑ 负 TiO2+4e-=Ti+O2- CH3OCH3+16OH--12e-=2CO32-+11H2O
TiCl4+2CO 2b-4c-a TiCl4+4H2O=Ti(OH)4↓+4HCl↑ 负 TiO2+4e-=Ti+O2- CH3OCH3+16OH--12e-=2CO32-+11H2O
【解析】(1)①沸腾炉中流程可知反应物为氯气、碳和TiO2,反应生成TiCl4和一氧化碳,反应的化学方程式为:TiO2+2C+2Cl2![]() TiCl4+2CO;②(I) Ti(s)+2Cl2(g)=TiCl4(l)△H=a kJ/mol;(II) 2Na(s)+Cl2(g)=2NaCl(s)△H=bkJ/mol;(III) Na(s)=Na(l)△H=ckJ/mol,根据方程式可知将方程式2(II)-(I)-4(III)得TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s),△H=2b-4c-a;③TiCl4遇水强烈水解,钛离子结合氢氧根离子形成氢氧化钛出的和氯化氢,反应进行彻底,反应的化学方程式TiCl4+4H2O=Ti(OH)4↓+4HCl↑;(2)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,和电源负极相连;电极反应式为TiO2+4e-=Ti+2O2-;(3)原电池中负极发生失去电子的氧化反应,因此二甲醚在负极通入,电解质溶液显碱性,因此该电池工作时负极的电极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O。
TiCl4+2CO;②(I) Ti(s)+2Cl2(g)=TiCl4(l)△H=a kJ/mol;(II) 2Na(s)+Cl2(g)=2NaCl(s)△H=bkJ/mol;(III) Na(s)=Na(l)△H=ckJ/mol,根据方程式可知将方程式2(II)-(I)-4(III)得TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s),△H=2b-4c-a;③TiCl4遇水强烈水解,钛离子结合氢氧根离子形成氢氧化钛出的和氯化氢,反应进行彻底,反应的化学方程式TiCl4+4H2O=Ti(OH)4↓+4HCl↑;(2)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,和电源负极相连;电极反应式为TiO2+4e-=Ti+2O2-;(3)原电池中负极发生失去电子的氧化反应,因此二甲醚在负极通入,电解质溶液显碱性,因此该电池工作时负极的电极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】某原电池总反应为:Cu+2Fe3+==Cu2++2Fe2+,下列能实现该反应的原电池是
A | B | C | D | |
电极材料 | Cu、C | Cu、Ag | Cu、Zn | Fe、Zn |
电解质溶液 | Fe(NO3)3 | FeSO4 | FeCl3 | CuSO4 |
A. A B. B C. C D. D