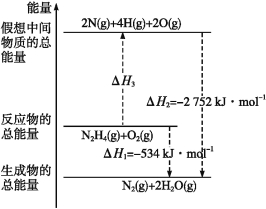
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A. 9.2g NO2和N2O4的混合物中含氮原子数目为0.2NA
B. 常温常压下,35.5gCl2与足量的NaOH溶液完全反应,转移的电子数为0.5NA
C. 标准状况下,2.24LNH3与1.6gCH4分子中所含电子数目均为NA
D. 已知反应N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1,当生成NA个NH3分子时,反应放出的热量小于46.2kJ
2NH3(g) △H=-92.4kJ·mol-1,当生成NA个NH3分子时,反应放出的热量小于46.2kJ
【答案】D
【解析】A. NO2和N2O4的最简式均为NO2,因此9.2g NO2和N2O4的混合物中含氮原子数目为0.2NA,A正确;B. 常温常压下,35.5gCl2是0.5mol,与足量的NaOH溶液完全反应生成氯化钠、次氯酸钠和水,转移的电子数为0.5NA,B正确;C. 标准状况下,2.24LNH3与1.6gCH4分子均是0.1mol,且均是19电子微粒,因此分子中所含电子数目均为(0.1×10)NA,C正确;D. 根据反应N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1可知当生成NA个NH3分子时,反应放出的热量等于46.2kJ,D错误,答案选D。
2NH3(g) △H=-92.4kJ·mol-1可知当生成NA个NH3分子时,反应放出的热量等于46.2kJ,D错误,答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
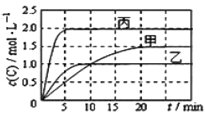
容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是( )
A. 由图可知Tl<T2,且正反应为吸热反应
B. 前5min内甲、乙、丙三个容器中反应的平均速率:v (A)乙<v(A)甲<v(A)丙
C. 平衡时A的转化率a : a乙<a甲<a丙
D. T2时该反应的平衡常数K=1.33