题目内容
4. 在密闭容器中存在反应:2SO2(g)+O2(g)═2SO3(g)△H<0,某研究小组研究该反应后作出了如图所示曲线.下列分析正确的是( )
在密闭容器中存在反应:2SO2(g)+O2(g)═2SO3(g)△H<0,某研究小组研究该反应后作出了如图所示曲线.下列分析正确的是( )| 选项 | Y的物理意义 | 甲、乙的物理意义 | 甲与乙的大小 |
| A | SO2的转率 | 温度 | 甲>乙 |
| B | SO2的体积分数 | 压强 | 甲>乙 |
| C | SO3的体积分数 | 温度 | 乙>甲 |
| D | SO2的转率 | 压强 | 乙>甲 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
分析 A、根据先拐先平的原理,由图乙先平衡,所以乙的速率快,则乙的温度高;
B、根据先拐先平的原理,由图乙先平衡,所以乙的速率快,则乙的压强大;
C、甲、乙的物理意义是温度,由图乙先平衡,所以乙的速率快,则乙的温度高,而正反应是放热反应,所以升高温度,平衡逆向移动;
D、甲、乙的物理意义是压强,由图乙先平衡,所以乙的速率快,则乙的压强大,而增大压强向气体体积缩小的方向移动,SO2转化率增大.
解答 解:A、甲、乙的物理意义是温度,由图乙先平衡,所以乙的速率快,则乙的温度高,故A错误;
B、甲、乙的物理意义是压强,由图乙先平衡,所以乙的速率快,则乙的压强大,故B错误;
C、甲、乙的物理意义是温度,由图乙先平衡,所以乙的速率快,则乙的温度高,而正反应是放热反应,所以升高温度,平衡逆向移动,三氧化硫的体积分数变小,故C正确;
D、甲、乙的物理意义是压强,由图乙先平衡,所以乙的速率快,则乙的压强大,而增大压强向气体体积缩小的方向移动,SO2转化率增大,而不是减小,故D错误;
故选C.
点评 本题考查影响化学反应速率的因素和外界条件对平衡移动的影响,题目难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
15.下列变化一定属于化学变化的是( )
①导电
②爆炸
③缓慢氧化
④SO2使品红溶液褪色
⑤无水硫酸铜由白变蓝
⑥工业制O2
⑦白磷转化为红磷
⑧久置浓硝酸变黄
⑨16O与18O间的相互转化.
①导电
②爆炸
③缓慢氧化
④SO2使品红溶液褪色
⑤无水硫酸铜由白变蓝
⑥工业制O2
⑦白磷转化为红磷
⑧久置浓硝酸变黄
⑨16O与18O间的相互转化.
| A. | ②③④⑦⑧⑨ | B. | ③④⑤⑦⑧ | C. | ②③⑥⑦⑨ | D. | ④⑤⑥⑧ |
19.下列叙述错误的是( )
| A. | 金属钠在自然界中可以以单质形式存在 | |
| B. | 金属钠燃烧时发出黄色火焰 | |
| C. | 金属钠保存在煤油中 | |
| D. | 金属钠在空气中燃烧生成过氧化钠 |
9.对于密闭容器中的可逆反应:mX(g)+nY(s)?pZ(g)△H<0,达化学平衡后,其他条件不变,改变下列条件,化学平衡一定发生移动的是( )
| A. | 增大压强 | B. | 通入氦气 | C. | 增加Y的物质的量 | D. | 升高温度 |
16.如图所示曲线a表示放热反应X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,采取的措施不可能是改变了( )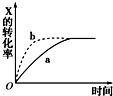

| A. | 温度 | B. | 压强 | C. | 浓度 | D. | 加催化剂 |
13.下列实验误差分析错误的是( )
| A. | 用润湿的pH试纸测稀酸溶液的pH,测定值偏大 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 用标准酸液滴定未知碱液时,若酸式滴定管未润洗,则测定结果偏大 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测结果偏低 |
 .
.