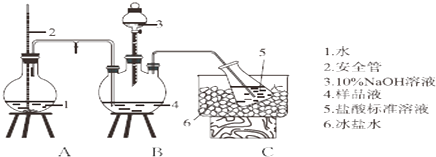
题目内容
19.下列叙述错误的是( )| A. | 金属钠在自然界中可以以单质形式存在 | |
| B. | 金属钠燃烧时发出黄色火焰 | |
| C. | 金属钠保存在煤油中 | |
| D. | 金属钠在空气中燃烧生成过氧化钠 |
分析 A.钠性质很活泼,极易和空气中氧气、水蒸气反应;
B.钠元素焰色反应呈黄色;
C.Na密度大于煤油且不和煤油反应;
D.钠在空气中燃烧生成过氧化钠.
解答 解:A.钠性质很活泼,极易和空气中氧气反应生成白色固体氧化钠,和空气中水蒸气反应生成氢氧化钠和氢气,所以钠不能在自然界中以单质存在,故A错误;
B.钠元素焰色反应呈黄色,所以钠燃烧时发出黄色光,故B正确;
C.钠极易和氧气、水反应,Na密度大于煤油且不和煤油反应,所以钠可以保存在煤油中,故C正确;
D.钠在空气中燃烧生成淡黄色固体过氧化钠,钠和氧气接触生成白色固体氧化钠,故D正确;
故选A.
点评 本题考查钠性质,为高频考点,钠原子最外层只有一个电子,性质很活泼,注意:焰色反应是元素性质而不是某种物质性质,且为物理性质.

练习册系列答案
相关题目
9.下列操作中发生复分解反应的是( )
| A. | 将碳酸钾加入氯化钠溶液中 | B. | 在硫酸铜溶液中加入铁片 | ||
| C. | 在盐酸中加入氢氧化钠溶液 | D. | 让铁丝在氧气中燃烧 |
10.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 mol NaHSO4晶体中离子总数为2NA | |
| B. | 4.4g 14CO2含中子数为2.4NA | |
| C. | 0.3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3NA | |
| D. | 1 molFe在氧气中燃烧失去的电子数为3NA |
14.为确定某溶液的离子组成,分别进行如下实验:
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以下推测正确的是( )
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以下推测正确的是( )
| A. | 不能确定HCO3-离子是否存在 | B. | 可能有CO32-离子 | ||
| C. | 一定有Cl-离子存在 | D. | 一定有SO42-离子 |
4. 在密闭容器中存在反应:2SO2(g)+O2(g)═2SO3(g)△H<0,某研究小组研究该反应后作出了如图所示曲线.下列分析正确的是( )
在密闭容器中存在反应:2SO2(g)+O2(g)═2SO3(g)△H<0,某研究小组研究该反应后作出了如图所示曲线.下列分析正确的是( )
 在密闭容器中存在反应:2SO2(g)+O2(g)═2SO3(g)△H<0,某研究小组研究该反应后作出了如图所示曲线.下列分析正确的是( )
在密闭容器中存在反应:2SO2(g)+O2(g)═2SO3(g)△H<0,某研究小组研究该反应后作出了如图所示曲线.下列分析正确的是( )| 选项 | Y的物理意义 | 甲、乙的物理意义 | 甲与乙的大小 |
| A | SO2的转率 | 温度 | 甲>乙 |
| B | SO2的体积分数 | 压强 | 甲>乙 |
| C | SO3的体积分数 | 温度 | 乙>甲 |
| D | SO2的转率 | 压强 | 乙>甲 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
11.分别往含有下列离子的溶液中通入氯气,离子浓度不会减少的是( )
| A. | Ag+ | B. | HCO3- | C. | I- | D. | Na+ |
8.有些地区水井中的水刚从井中抽出时是清澈透明的,但烧开后发现产生了红褐色的不溶物.某中学研究性学习小组对这种现象进行了分析:向刚抽出的井水中加入硫氰化钾溶液,无明显现象;向产生不溶物的水中加入盐酸,不溶物溶解,再向其中加入硫氰化钾溶液,溶液呈现血红色.则下列说法不正确的是( )
| A. | 该井水中肯定有Fe3+ | |
| B. | 该井水中肯定有Fe2+ | |
| C. | 红褐色不溶物是Fe(OH)3 | |
| D. | 红褐色不溶物是由于氧化和水解产生 |
9.四种短周期元素在周期表中的位置如图,其中只有M为金属元素,下列说法不正确的是( )
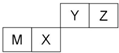

| A. | 原子半径Z<M | |
| B. | Z位于元素周期表中第2周期、第ⅥA族 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | X的最高价氧化物不溶于任何酸 |