题目内容
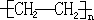
12.写出下列变化的化学方程式:(1)由乙烯为原料合成聚乙烯nCH2═CH2
(2)乙烯和溴的四氯化碳溶液的反应Br2+CH2=CH2→BrCH2-CH2Br
(3)乙醇和金属钠的反应2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
(4)苯和浓硝酸的反应
 .
.
分析 书写化学方程式时首先要正确写出反应物和生成物的化学式,然后配平,再注明反应条件.
(1)根据乙烯中的官能团双键所具有的性质可知乙烯发生聚合反应生成聚乙烯,根据加聚反应特点写方程式;
(2)根据乙烯中的官能团双键所具有的性质可知乙烯和溴发生加成反应;
(3)根据乙醇与与金属钠反应生成乙醇钠和氢气,断开羟基上的氢氧键来书写;
(4)在浓硫酸作催化剂、加热条件下,苯和浓硝酸发生取代反应生成硝基苯.
解答 解:(1)乙烯含有碳碳双键,根据加聚反应的特点,双键变单键,断开的单键相连接形成高分子化合物,故乙烯加聚成聚乙烯方程式为:nCH2═CH2 ;
;
故答案为:nCH2═CH2 ;
;
(2)乙烯中的官能团为双键,能够和溴加成,故将乙烯通入溴的四氯化碳溶液中,观察到的现象是溴的红棕色褪去;加成反应的特点是双键变单键,断键处加上加成试剂原子即可,方程式为Br2+CH2=CH2→BrCH2-CH2Br,
故答案为:Br2+CH2=CH2→BrCH2-CH2Br;
(3)乙醇与与金属钠反应生成乙醇钠和氢气,断开羟基上的氢氧键,反应方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
(4)在浓硫酸作催化剂、加热条件下,苯和浓硝酸发生取代反应生成硝基苯,反应方程式为 ,
,
故答案为: .
.
点评 本题考查了物质之间的反应,明确物质的性质是解本题关键,侧重有机物官能团的考查,注意苯发生取代反应时硝基的写法,为易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A. | 金属氧化物 过氧化钠 Na2O | B. | 酸 硫酸 H2SO4 | ||
| C. | 盐 苛性钠 NaOH | D. | 碱 纯碱 Na2CO3 |
3.利用如图所示的有机物X可生产S-诱抗素Y.下列说法正确的是( )


| A. | 1mol X与足量NaOH溶液反应,最多消耗4mol NaOH | |
| B. | Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 | |
| C. | X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐 | |
| D. | X结构中有2个手性碳原子 |
20.将一定体积密度为1.32g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止.已知反应后所得溶液的质量等于原BaCl2溶液的质量,则原硫酸溶液浓度为( )
| A. | 23.9% | B. | 11.0% | C. | 13.5mol/L | D. | 5.67mol/L |
17.等质量的两份铜,分别与足量的浓硝酸和稀硝酸完全反应,在相同条件下再用排水法收集反应产生的气体,下列叙述正确的是( )
| A. | 浓硝酸消耗的HNO3少,而稀硝酸消耗的多 | |
| B. | 两者生成的Cu(NO3)2的物质的量不相同 | |
| C. | 两者用排水法收集的气体体积相同 | |
| D. | 浓硝酸产生的NO2少,而稀硝酸产生的NO多 |
4. 在密闭容器中存在反应:2SO2(g)+O2(g)═2SO3(g)△H<0,某研究小组研究该反应后作出了如图所示曲线.下列分析正确的是( )
在密闭容器中存在反应:2SO2(g)+O2(g)═2SO3(g)△H<0,某研究小组研究该反应后作出了如图所示曲线.下列分析正确的是( )
 在密闭容器中存在反应:2SO2(g)+O2(g)═2SO3(g)△H<0,某研究小组研究该反应后作出了如图所示曲线.下列分析正确的是( )
在密闭容器中存在反应:2SO2(g)+O2(g)═2SO3(g)△H<0,某研究小组研究该反应后作出了如图所示曲线.下列分析正确的是( )| 选项 | Y的物理意义 | 甲、乙的物理意义 | 甲与乙的大小 |
| A | SO2的转率 | 温度 | 甲>乙 |
| B | SO2的体积分数 | 压强 | 甲>乙 |
| C | SO3的体积分数 | 温度 | 乙>甲 |
| D | SO2的转率 | 压强 | 乙>甲 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
1.用NA代表阿伏伽德罗常数,下列说法正确的是( )
| A. | 标准状况下,2.24LCHCl3的分子数0.1NA | |
| B. | 用惰性电极电解1 L浓度均为2 mol•L-1的AgNO3与Cu(NO3)2的混合溶液,当有0.2 NA个电子转移时,理论上阴极析出6.35g金属 | |
| C. | 9.2gNO2和N2O4的混合气中含有的氮原子数为大于0.2NA | |
| D. | VL a mol•L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA |