题目内容
6.工业上用DME法以H2和C0为原料生产甲醚(CH3OCH3)其原理是在同一容器中发生如下两个连续反应:①2H2(g)+CO(g)?CH3OH(g〕
②2CH3OH(g)?CH3OCH3(g)+H20(g)
当达到平衡时实验数锯如表,下列分析正确的是( )
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 52 |
| A. | 反应①、②均为吸热反应 | |
| B. | 290℃时反应②K值达到最大 | |
| C. | 平衡时,反应①与②中CH3OH的消耗速率一定相等 | |
| D. | 增大压强能增大CH3OCH3产率 |
分析 A.CO的转化率随温度升高而降低,说明升高温度反应①平衡逆向移动,甲醚的产率开始随温度升高而增大,说明升高温度反应②向正反应移动;
B.反应②为吸热反应,升高温度平衡正向移动,温度越高平衡常数越大;
C.甲醇处于2个不同的反应体系,不能确定反应速率问题;
D.增大压强,不影响反应②的平衡移动,但反应①向正反应移动,甲醇浓度增大,使反应②正向移动.
解答 解:A.CO的转化率随温度升高而降低,说明升高温度反应①平衡逆向移动,正反应为放热反应,甲醚的产率开始随温度升高而增大,说明升高温度反应②向正反应移动,正反应为吸热反应,故A错误;
B.反应②为吸热反应,升高温度平衡正向移动,温度越高平衡常数越大,290℃时反应②K值不是最大,而温度高时甲醚产率减小,是由反应①逆向移动,甲醇浓度减小所致,①起主导作用,故B错误;
C.甲醇处于2个不同的反应体系,不能确定反应速率问题,故C错误;
D.增大压强,虽然不影响反应②的平衡移动,反应①为气体体积减小的反应,增大压强平衡正向移动,甲醇的浓度增大,使反应②正向移动,增大CH3OCH3产率,故D正确,
故选:D.
点评 本题考查化学平衡计算与影响因素,注意容器内2个关联的平衡体系相互影响,侧重考查学生分析能力,难度中等.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
3.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol甲基所含有的电子数为10NA | |
| B. | 标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA | |
| C. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA | |
| D. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA |
16.下列溶液中各微粒的浓度关系正确的是( )
| A. | pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液:c(NH4+)大小顺序为①>②>③ | |
| B. | 0.l mol•L-1CuSO4•(NH4)2SO4•6H2O溶液:c(SO42-)>c(NH4+)>c(Cu2+)>c(OH-)>c(H+) | |
| C. | 0.1 mol•L-1Na2CO3溶液:C(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 等体积、等物质的量浓度的CH3COONa和CH3COOH混合后的溶液:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
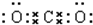 .
.
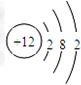 ,固体A的化学式为Al(OH)3;
,固体A的化学式为Al(OH)3;
