题目内容
【题目】实验小组按如下流程,进行海带中碘含量的测定和碘的制取等实验。
I. 碘含量的测定

(1)步骤①是将海带置于__________中(填仪器名称)进行灼烧。
(2)步骤④是将溶液转移至________________(填定容仪器的名称)。
(3)取20.00mL 上述海带浸取原液,加稀H2SO4和足量KIO3,使![]() 和
和![]() 完全反应(
完全反应(![]() )。再以淀粉为指示剂,用
)。再以淀粉为指示剂,用![]() mol/L的Na2S2O3溶液滴定(
mol/L的Na2S2O3溶液滴定(![]() ),当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。
),当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。
(4)判断用Na2S2O3溶液滴定恰好完全反应的现象是__________________________。
(5)计算该干海带中碘的质量分数_________________。
II. 碘的制取
另制海带浸取原液,按如下方案制取碘:
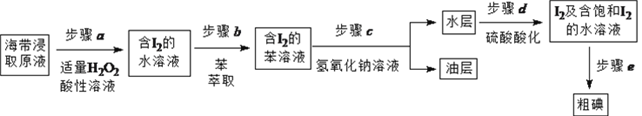
(1)补全步骤![]() 的反应方程式,配平并标出电子转移的数目和方向。
的反应方程式,配平并标出电子转移的数目和方向。
![]() ,_______________
,_______________
(2)步骤![]() 加入足量NaOH溶液、振荡、静置后,油层在_____(填“上”或“下”)层,呈____色。
加入足量NaOH溶液、振荡、静置后,油层在_____(填“上”或“下”)层,呈____色。
(3)步骤![]() 的操作是_______________。
的操作是_______________。
【答案】 坩埚 500mL容量瓶 滴入最后一滴Na2S2O3溶液,振荡,溶液蓝色褪去且半分钟内无明显变化 0.053 H2O2+2I-+2H+→I2+2H2O,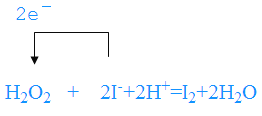 上 无 过滤
上 无 过滤
【解析】I.
(1)用于灼烧的仪器是坩埚,可以直接加热。(2)此过程配成了500ml溶液,所以所用仪器为500mL容量瓶。(3)滴定到终点时碘单质恰好完全反应,此时溶液的蓝色褪去,所以现象为:滴入最后一滴Na2S2O3溶液,振荡,溶液蓝色褪去且半分钟内无明显变化(4)由题中数据可知n(![]() )=
)=![]() mol/L
mol/L![]() 20.00mL
20.00mL![]() =4
=4![]() mol.由
mol.由![]() 可知n(
可知n(![]() )=2
)=2![]() mol m(
mol m(![]() )=2
)=2![]() mol
mol![]() 254
254![]() 25=0.127g
25=0.127g
再由![]() 可知m(I-)=0.106g, 由此可知质量分数为0.105/20.00=0.053
可知m(I-)=0.106g, 由此可知质量分数为0.105/20.00=0.053
2e-
![]()
(1)H2O2 + 2I-+2H+=I2+2H2O(2)油层密度比水小应该在上层,由于碘和氢氧化钠反应,所以油层为无色。(3)将固体和溶液分开用过滤操作。