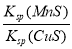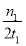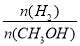题目内容
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________________________
②利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式___________________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1

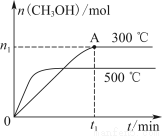
测得CH3OH的物质的量随时间变化如上图所示,回答问题:
①下列措施中能使n(CH3OH)/n(CO2)增大的是________。
A.升高温度 B.充入He(g)使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1 mol CO2和3 mol H2
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“大于”“等于”或“小于”)。
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始时的 ,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
(3)用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1的NaOH溶液和20.00 mL 0.10 mol·L-1氨水所得的滴定曲线如下:

请指出盐酸滴定氨水的曲线为________(填“A”或“B”),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序________。
(1)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-28.5 kJ·mol-1
②CO+4OH--2e-=CO32—+2H2O
(2)①CD
②大于
③0.4<c≤1
(3)B c(NH4+)>c(Cl-)>c(OH-)>c(H+)
【解析】(1)①根据盖斯定律,第一个方程式减去3乘以第二个方程式得Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=ΔH1-3ΔH2=489.0 kJ·mol-1-3×172.5 kJ·mol-1=-28.5 kJ·mol-1。②该燃料电池的总反应方程式为2CO+O2+4OH-=2CO32—+2H2O……①,电池正极反应式为O2+2H2O+4e-=4OH-……②,(①-②)÷2得负极反应式为CO+4OH--2e-=CO32—+2H2O。
(2)①A项,升高温度,平衡逆向移动,使比值减小;B项,恒容时充入不反应的气体,平衡不移动,比值不变;C项,将H2O(g)从体系中分离,平衡正向移动,使比值增大;D项,相当于增大压强,平衡正向移动,使比值增大。②曲线Ⅱ优先达到平衡且平衡时生成物CH3OH的物质的量小,说明曲线Ⅱ对应的温度高,升高温度放热反应的平衡常数减小。③甲、乙为等效平衡,甲起始时n(CO2)=1 mol,所以c≤1;利用三段式法可求得甲达到平衡时n(CH3OH)=n(H2O)=0.4 mol,要维持乙中反应起始时逆向进行,需使c>0.4。
(3)NH3·H2O是弱碱,浓度均为0.10 mol·L-1的NaOH溶液和氨水,氨水的pH小,故盐酸滴定氨水的曲线是B;a点pH>7,说明该点氨水过量,溶液中的溶质是NH4Cl和NH3·H2O,故溶液中离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+)

新的《环境空气质量标准》将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
(1)汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因________________________________________
(2)汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
则反应2NO(g)+2CO(g)??N2(g)+2CO2(g)的ΔH=________kJ·mol-1;该反应的ΔS________0(填“>”“<”或“=”)。
(3)将0.20 mol NO和0.10 mol CO充入一个容积恒定为1 L的密闭容器中,在不同条件下反应过程中部分物质的浓度变化状况如图所示。
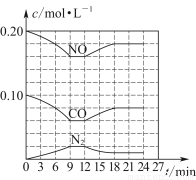
①计算产物N2在6~9 min时的平均反应速率v(N2)=________mol·L-1·min-1;
②第12 min时改变的反应条件为________(填“升温”或“降温”);
③计算反应在第24 min时的平衡常数K=________。若保持温度不变,再向容器中充入CO、N2各0.060 mol,平衡将________移动(填“正向”“逆向”或“不”)。
(4)环境监测中还可用沉淀法测定空气中含有较高浓度SO2的含量,经查得一些物质在20 ℃的数据如下表:
溶解度(S)/g | 溶度积(Ksp) | ||
Ca(OH)2 | Ba(OH)2 | CaSO3 | BaSO3 |
0.160 | 3.89 | 6.76×10-3 | 5.48×10-9 |
①吸收SO2最合适的试剂是________[填“Ca(OH)2”或“Ba(OH)2”]溶液;
②在20 ℃时,向CaSO3悬浊液中滴加适量的BaCl2溶液,当CaSO3向BaSO3的转化达到平衡时,溶液中的 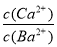 =____________(写出表达式即可)。
=____________(写出表达式即可)。