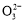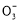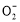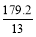题目内容
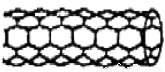
如图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )


A.②①③④⑤⑥ B.⑤④②①③⑥
C.⑤④③①②⑥ D.⑤③②④①⑥
B
【解析】在同一电解质溶液中,金属腐蚀的快慢规律如下:电解池的阳极>原电池的负极(两极材料的活泼性差别越大,氧化还原反应的速率越快)>化学腐蚀>牺牲阳极的阴极保护法>外接电源的阴极保护法。

 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案下表是五种银盐的溶度积常数(25 ℃):
化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
下列说法不正确的是( )
A.五种物质在常温下Ag2SO4饱和溶液中c(Ag+)最大
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.对于氯化银、溴化银和碘化银三种物质在常温下的饱和溶液中c(Ag+)随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________________________
②利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式___________________________________________
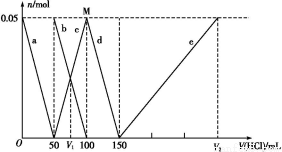
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1

测得CH3OH的物质的量随时间变化如上图所示,回答问题:
①下列措施中能使n(CH3OH)/n(CO2)增大的是________。
A.升高温度 B.充入He(g)使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1 mol CO2和3 mol H2
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“大于”“等于”或“小于”)。
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始时的 ,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
(3)用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1的NaOH溶液和20.00 mL 0.10 mol·L-1氨水所得的滴定曲线如下:

请指出盐酸滴定氨水的曲线为________(填“A”或“B”),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序________。