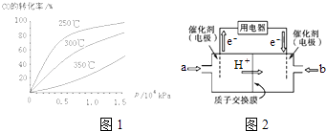
题目内容
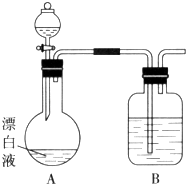
【题目】对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和浓药的合成,实验室中制备对氯苯甲酸的反应、装置图如图2: 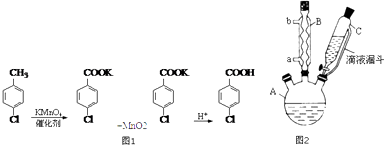
常温条件下的有关数据如表所示:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 颜色 | 水溶性 | |
对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
对氯苯甲酸钾 | 194.5 | 具有盐的通性,属于可溶性盐 | ||||
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g.
请回答下列问题:
(1)装置B的名称是 .
(2)量取6.00mL对氯甲苯应选用的仪器是 . (填选仪器序号).
A.10mL量筒
B.50mL容量瓶
C.50mL酸式滴定管
D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是 . 对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是 .
(4)第一次过滤的目的是 , 滤液中加入稀硫酸酸化,可观察到的实验现象是 .
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是 .
(6)本实验的产率是(填标号).
A.60%
B.70%
C.80%
D.90%
【答案】
(1)冷凝管
(2)C
(3)水浴加热;减少对氯甲苯的挥发,提高原料利用率
(4)除去MnO2;产生白色沉淀
(5)可除去对氯苯甲酸表面的可溶性杂质且尽量减小对氯苯甲酸的损耗
(6)D
【解析】解:(1)由仪器的图形可知,B为冷凝管;
所以答案是:冷凝管;(2)量取6.00mL对氯甲苯,结合量取体积精度可知应选择滴定管,对氯甲苯是一种优良的有机溶剂,对碱式滴定管上橡胶制品有明显的溶解腐蚀作用,则选50mL酸式滴定管,
所以答案是:C;(3)控制温度在93℃左右,低于水的沸点,可以采取水浴加热,对氯甲苯易挥发,对氯甲苯的加入方法是逐滴加入而不是一次性加入,以提高原料的利用率,
所以答案是:水浴加热;减少对氯甲苯的挥发,提高原料利用率;(4)对氯甲苯和适量KMnO4反应生成对氯苯甲酸钾和二氧化锰,二氧化锰不溶于水,步骤③过滤得到滤渣MnO2;滤液中加入稀硫酸酸化,对氯苯甲酸钾与稀硫酸反应生成对氯苯甲酸,对氯苯甲酸微溶于水,是白色沉淀,可观察到的实验现象是产生白色沉淀;
所以答案是:除去MnO2;产生白色沉淀;(5)对氯苯甲酸微溶于水,热水洗涤可能增大对氯苯甲酸的溶解度使其损耗,用冷水进行洗涤既可除去对氯苯甲酸表面的可溶性杂质还能减小对氯苯5酸的损耗;
所以答案是:可除去对氯苯甲酸表面的可溶性杂质且尽量减小对氯苯甲酸的损耗;(6)对氯甲苯的质量为:6ml×1.07gcm﹣3=6.42g,由 ![]() ~
~ ![]() ,可知对氯苯甲酸的理论产量为
,可知对氯苯甲酸的理论产量为 ![]() ×156.5g,
×156.5g,
则对氯苯甲酸的产率为:[7.19g÷( ![]() ×156.5g)]×100%≈90%,故选D.
×156.5g)]×100%≈90%,故选D.

【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“ 0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2-3次;
请回答下列问题:
(1)以上步骤有错误的是(填编号)_____________,该错误操作会导致测定结果_________ (填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用________________ (填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果____________(填“大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视_______________________;判断到达滴定终点的依据是_______。
(4)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.10 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.22 |
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是(______)
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视读数
(5)根据上表记录数据,通过计算可得,该盐酸浓度为____________mol·L-1

(6)室温下,用0.100mol/L NaOH溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是(______)
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗V(NaOH)小于20mL
C.V(NaOH) =20mL时,c( Cl- )=c(CH3COO- )
D.V(NaOH) =10mL时,醋酸溶液中:c( Na+ )> c(CH3COO-)> c( H+ )> c(OH-)