题目内容
【题目】某温度下,体积一定的密闭容器中进行反应:![]()
![]() 。下列分析正确的是
。下列分析正确的是
A. 平衡后加入![]() ,该反应的
,该反应的![]() 增大
增大
B. 平衡后升高温度,平衡常数K变大
C. 平衡后再充入![]() ,达到新平衡时,
,达到新平衡时, ![]() 的百分含量变大
的百分含量变大
D. 若反应前充入的![]() 与
与![]() 物质的量相等,达平衡时
物质的量相等,达平衡时![]() 的转化率比
的转化率比![]() 的高
的高
【答案】C
【解析】A、△H是与反应本身有关的一个量,不因为反应物的量的变化而改变,故A错误;B、△H<0表示反应为放热反应,平衡时升高温度,平衡向逆反应方向移动,平衡常数K变小,故B错误;C、平衡后再充入NH3,等效于在原来的基础上压缩容器的体积,压强增大,平衡右移,达到新平衡时,NH3的百分含量变大,故C正确;D、设反应前充入的N2与H2物质的量相等且都为1mol,反应中转化的N2物质的量为xmol,则转化的H2为3xmol,转化率之比为1:3,H2的转化率大,故D错误;故选C。

练习册系列答案
相关题目
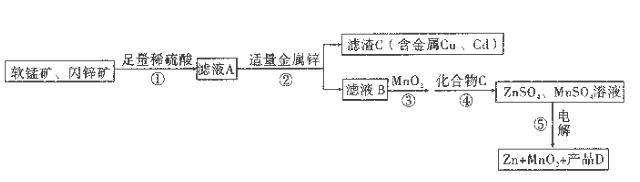
【题目】X、Y两根金属棒插入Z溶液中构成如图所示的装置,实验中电流计指针发生偏转,同时X棒变粗,Y棒变细,则X、Y和Z溶液可能是下列中的( )
编号 | X | Y | Z溶液 |
|
A | Zn | Cu | 稀硫酸 | |
B | Cu | Zn | 稀硫酸 | |
C | Cu | Ag | 硫酸铜溶液 | |
D | Ag | Zn | 硝酸银溶液 |
A. A B. B C. C D. D