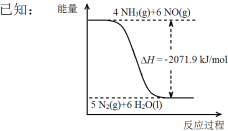
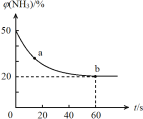
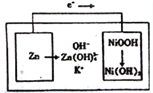
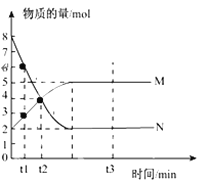
��Ŀ����
����Ŀ���� ��MnO2��Zn�Ĺ��ռ�������ͼ��ʾ(�м����Ĺ��岿���Ѿ���ȥ):

���̿�: MnO2������65%��Al2O3����Ϊ4%����п��: ZnS������80%�� FeS��CuS��CdS������Ϊ2%�� ��ҺB�к���������: Zn2+��Mn2+�� Fe2+��Al3+��
�Իش���������:
��1������������̿���п����������Һ����ʱ���������ҽ���Ԫ��ת��Ϊ��Ӧ��������(��Ԫ����+3�۴���)�� ����MnO2��FeS���������ӷ���ʽΪ___________________________��
��2������� �е�MnO2Ҳ��������___________________���ʴ���(������Mn2+�ķ�Ӧ)
A.KMnO4 ���� B.H2O2 C.Ũ���� D.������ˮ
��3�� ����ݵ������������ĵ缫��ӦʽΪ___________________________��
��4�����뻯����C��ɵô�����ZnSO4 ��MnSO4��Һ��C������ZnO��Zn(OH)2��Mn (OH)2 ��MnCO3,
���ƷDΪ___________________________(�ѧʽ)��
��5��I .���Ƶõ�MnO2(s)��KOH(s)��KClO3(s)(��������ϣ���������(���Ͻ���)�ɵ�KCl��K2MnO4�Ĺ������
II.����5%��KOH��Һ�ܽ����ɫ(MnO42-)��Һ��
III.����ɫ��Һ��ͨ��������CO2����Һ���ȣ���������ȥ����( ��MnO2(s)]��
IV.����Һ����Ũ������ȴ��Ʒ�����ˡ�ϴ�ӡ��������ɫKMnO4���塣
�ٵ�III�������������ȹ�������Ŀ����___________________________��
�� д��III������KMnO4�Ļ�ѧ��ʽ__________________________________��
��III�������CO2����������CO2��������ʹ���ò�Ʒ�Ĵ��Ƚ��ͣ�ԭ�������___________________
���𰸡� 3MnO2+2FeS+12H+![]() 2Fe3++3Mn2++2S+6H2O B Mn2+-2e-+2H2O=MnO2+4H+ H2SO4 ��ֹ�¶Ƚ��ͣ�KMnO4 ���������²����½� 2CO2+3K2MnO4
2Fe3++3Mn2++2S+6H2O B Mn2+-2e-+2H2O=MnO2+4H+ H2SO4 ��ֹ�¶Ƚ��ͣ�KMnO4 ���������²����½� 2CO2+3K2MnO4![]() 2KMnO4+MnO2��+2K2CO3 ͨ�����CO2�������ܽ��С��KHCO3����KMnO4����һ������
2KMnO4+MnO2��+2K2CO3 ͨ�����CO2�������ܽ��С��KHCO3����KMnO4����һ������
�������������������1������������MnO2��FeS��Ӧ����S��MnSO4��Fe2(SO4)3����2��������е�MnO2����������Fe2+����ΪFe3+��Ϊ�����������ʣ�������H2O2����MnO2����3������ݵ�������MnSO4��ZnSO4����Zn��MnO2������ʧ���ӷ���������Ӧ����4�����뻯����C��ɵô�����ZnSO4��MnSO4��Һ ��������Ӧʽ��Mn2+-2e-+2H2O=MnO2+4H+�����Բ�ƷDΪH2SO4����5�����¶Ƚ��ͣ�KMnO4 �ܽ�ȼ�С�������� III��CO2��K2MnO4��Ӧ����KMnO4��MnO2��K2CO3����III����CO2�������������ܽ��С��KHCO3��
��������1������������MnO2��FeS��Ӧ����S��MnSO4��Fe2(SO4)3����Ӧ���ӷ���ʽ��3MnO2+2FeS+12H+![]() 2Fe3++3Mn2++2S+6H2O����2��������е�MnO2����������Fe2+����ΪFe3+��Ϊ�����������ʣ�������H2O2����MnO2����3������ݵ�������MnSO4��ZnSO4����Zn��MnO2������ʧ���ӷ���������Ӧ������������Ӧʽ��Mn2+-2e-+2H2O=MnO2+4H+����4�����뻯����C��ɵô�����ZnSO4��MnSO4��Һ ��������Ӧʽ��Mn2+-2e-+2H2O=MnO2+4H+�����Բ�ƷDΪH2SO4����5���ٵ�III�������������ȹ�������Ŀ���Ƿ�ֹ�¶Ƚ��ͣ�KMnO4 ���������²����½����� III��CO2��K2MnO4��Ӧ����KMnO4��MnO2��K2CO3����Ӧ����ʽ��2CO2+3K2MnO4
2Fe3++3Mn2++2S+6H2O����2��������е�MnO2����������Fe2+����ΪFe3+��Ϊ�����������ʣ�������H2O2����MnO2����3������ݵ�������MnSO4��ZnSO4����Zn��MnO2������ʧ���ӷ���������Ӧ������������Ӧʽ��Mn2+-2e-+2H2O=MnO2+4H+����4�����뻯����C��ɵô�����ZnSO4��MnSO4��Һ ��������Ӧʽ��Mn2+-2e-+2H2O=MnO2+4H+�����Բ�ƷDΪH2SO4����5���ٵ�III�������������ȹ�������Ŀ���Ƿ�ֹ�¶Ƚ��ͣ�KMnO4 ���������²����½����� III��CO2��K2MnO4��Ӧ����KMnO4��MnO2��K2CO3����Ӧ����ʽ��2CO2+3K2MnO4![]() 2KMnO4+MnO2��+2K2CO3����III����CO2�������������ܽ��С��KHCO3����KMnO4����һ��������ʹ���ò�Ʒ�Ĵ��Ƚ�����
2KMnO4+MnO2��+2K2CO3����III����CO2�������������ܽ��С��KHCO3����KMnO4����һ��������ʹ���ò�Ʒ�Ĵ��Ƚ�����

 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�