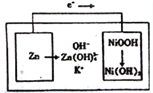
题目内容
【题目】下列图示与对应的叙述相符的是
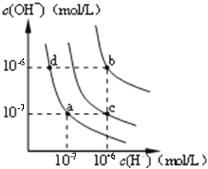


甲 乙 丙
A. 图甲中纯水仅升高温度,就可以从a点变到c点
B. 图甲中在b点对应温度下,将pH=2的H2SO4溶液与pH=10的NaOH溶液等体积混合后,溶液显中性
C. 图乙表相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
D. 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/L,C1-、Br-及I-的混合溶液,由图丙曲线,可确定首先沉淀的是Cl-
【答案】B
【解析】升高温度水的电离平衡正向移动,应该是氢离子和氢氧根离子浓度都增大,所以纯水仅升高温度,不可能从a点变到c点,选项A错误。B点对应的温度下,KW=1×10-12。此时pH=2的H2SO4溶液中c(H=)=0.01mol/L,pH=10的NaOH溶液中c(OH-)=0.01mol/L,两个溶液等体积混合后,恰好中和溶液显中性,选项B正确。加水稀释时应该是强酸pH变化较快(因为没有酸的电离平衡存在),弱酸pH变化较慢(因为加水稀释会促进弱酸的电离),所以曲线Ⅰ表示盐酸,曲线Ⅱ表示醋酸。pH越高代表氢离子浓度越小,所以b点氢离子浓度更小,导电性更差,选项C错误。从图像中得到加入相同的硝酸银时,I-的浓度最小(注意:纵坐标是-lg(X-),所以纵坐标的值越大,代表离子浓度越小),所以说明AgI的KSP最小,首先沉淀的应该是AgI。选项D错误。

练习册系列答案
相关题目