题目内容
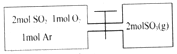
【题目】生石灰是常用的建筑材料,常采用煅烧石灰石来制取。体积为1L的真空密闭容器中加入0.5moL碳酸钙,发生的反应CaCO3(s)![]() CaO(s)+CO2(g)△H ,测得二氧化碳的物质的量浓度随温度变化关系如图所示。
CaO(s)+CO2(g)△H ,测得二氧化碳的物质的量浓度随温度变化关系如图所示。
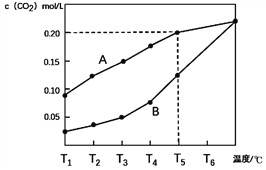
图A表示CO2的平衡浓度随温度变化的关系曲线
图B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线
回答下列相关问题:
(1)CaCO3(s)![]() CaO(s)+CO2(g) △H ____ 0(填>,<或=)。
CaO(s)+CO2(g) △H ____ 0(填>,<或=)。
(2)在T5℃下,维持温度和容器体积不变,向上述平衡体系再充入0.5moL氮气,则最后的平衡时容器中的碳酸钙质量为____克;若在T5℃下,维持温度和总压强不变,向原平衡体系再充入0.5moL氮气,则容器中最后残留的碳酸钙质量为____克。
(3)请说明随着温度升高,曲线B向曲线A逼近的原因____
(4)以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。
相关主要反应如下:
I. C(s) + H2O(g)![]() CO(g) + H2(g) △H = + 131. 6 kJ·mol-1
CO(g) + H2(g) △H = + 131. 6 kJ·mol-1
II. CO(g) + H2O(g)![]() CO2(g) + H2(g) △H = -43 kJ·mol-1
CO2(g) + H2(g) △H = -43 kJ·mol-1
III. CaO(s)+CO2(g)![]() CaCO3(s) △H = -178. 3 kJ·mol-1
CaCO3(s) △H = -178. 3 kJ·mol-1
①计算反应Ⅳ C(s) + 2H2O(g) + CaO(s)![]() CaCO3(s) + 2H2 (g)的△H =____kJ·mol-1。
CaCO3(s) + 2H2 (g)的△H =____kJ·mol-1。
若K1、K2、K3分别为反应I、II、III的平衡常数,则反应Ⅳ的平衡常数K=____
(用含K1、K2、K3的式子表示)。
②对于可逆反应 C(s)+2H2O(g)+CaO(s)![]() CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是____。(填字母编号)
CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是____。(填字母编号)
A. 适当的降低体系的温度 B. 压缩容器的体积
C. 用镧镍合金(LaNi5)吸收氢气 D. 增加CaO的量
(5)将碳酸钙固体与CO2饱和水溶液充分接触,某温度下CO2饱和水溶液中H2CO3的浓度0.03moL·L-1,水的pH约等于6,这种情况下钙离子最大浓度为____moL·L-1 。(计算结果保留两位有效数字)(CaCO3的KSP=2.8×10-9,碳酸K1=4.3×10-7 K2=4.7×10-11)
【答案】 > 30 0 温度升高,反应速率加快,达到平衡所需时间缩短 -89.7 kJ·mol—1 K1·K2·K3 AC 0.0046(0.0047也正确)
【解析】(1)根据图像,二氧化碳的物质的量浓度随温度升高而升高,平衡向右移动,该反应正向即为吸热反应,故△H > 0;
(2)体积为1L的真空密闭容器中加入0.5moL碳酸钙,发生的反应CaCO3(s)![]() CaO(s)+CO2(g),T5℃下,n(CO2)=0.2mol,故碳酸钙还有0.3mol,向上述平衡体系再充入0.5moL氮气,平衡不移动,故碳酸钙质量为30g;T5℃下,该反应的K=c(CO2)=0.2,维持温度和总压强不变,向原平衡体系再充入0.5moL氮气,此时容器体积变成3.5L,平衡向右移动,因为K不变,所以新的平衡时c(CO2)=0.2mol/L,假设体积仍是3.5L(实际上会更大),新的平衡时n(CO2)=0.7mol,而CO2最多为0.5mol,故该反应几乎进行完全,最后碳酸钙质量为0g;
CaO(s)+CO2(g),T5℃下,n(CO2)=0.2mol,故碳酸钙还有0.3mol,向上述平衡体系再充入0.5moL氮气,平衡不移动,故碳酸钙质量为30g;T5℃下,该反应的K=c(CO2)=0.2,维持温度和总压强不变,向原平衡体系再充入0.5moL氮气,此时容器体积变成3.5L,平衡向右移动,因为K不变,所以新的平衡时c(CO2)=0.2mol/L,假设体积仍是3.5L(实际上会更大),新的平衡时n(CO2)=0.7mol,而CO2最多为0.5mol,故该反应几乎进行完全,最后碳酸钙质量为0g;
(3)图B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线,前面一直在A下面,说明反应时间较短,温度升高,反应速率加快,达到平衡所需时间缩短,故曲线B向曲线A逼近;
(4)①根据盖斯定律,Ⅳ应为:I+II+III=Ⅳ,故△H= + 131. 6 -43-178. 3=-89.7 kJ·mol—1;方程式相加,则平衡常数相乘,故反应Ⅳ的平衡常数K= K1·K2·K3;
②A.该反应为放热反应,降低温度,平衡右移,H2产率增大,故A正确;B、压缩体积,平衡不移动,B错误;C、用镧镍合金(LaNi5)吸收氢气,平衡右移,H2产率增大,故C正确;D、增加固体的量,平衡不移动,故D错误;故选AC;
(5)c(HCO3-)=![]() c(CO32-)=
c(CO32-)=![]() c(Ca2+)=
c(Ca2+)=![]()

 口算能手系列答案
口算能手系列答案【题目】对炼锌厂的铜镉废渣中各元素进行分离,能减少环境污染,同时制得食品锌强化剂的原料ZnSO4·7H2O实现资源的再利用。其流程图如下。

[相关资料]
①铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
③Zn(OH)2属于两性氢氧化物。
④滤液I中有Fe2+、Zn2+、Cu2+、Cd2+和少量的AsO![]() 。
。
⑤有关离子沉淀完全的pH
金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高铜镉废渣浸出率可以采用的方法是(写出其中一点即可)____;
(2)向滤液I中逐滴滴人酸性KMnO4溶液可与AsO![]() 发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用试剂为____;
(4)上述流程除了实现对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用,还可以得到副产物___
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池的工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的正极反应式为____;
(6)若a克铜镉废渣含有b molFe元素,加入了c mol KMnO4,则铜镉废渣中As元素的质量分数为____。(不考虑镉元素与KMnO4的反应)