题目内容
【题目】下列有关有机化学的说法中正确的是( )
A.除去硬脂酸钠溶液中的甘油方法是:往溶液中加入饱和食盐水,分液
B.治疗疟疾的青蒿素(如图)  ,分子式是C15H20O5
,分子式是C15H20O5
C.有机物 ![]() 可发生加成反应、氧化反应、还原反应和聚合反应
可发生加成反应、氧化反应、还原反应和聚合反应
D. 右图所示的有机物分子式为C14H12O2 , 不能发生银镜反应
右图所示的有机物分子式为C14H12O2 , 不能发生银镜反应
【答案】C
【解析】解:A.向硬脂酸钠和甘油的混合物中加入食盐,能引起硬质酸钠的盐析,可用过量的方法分离,故A错误;
B.由结构简式可知有机物的分子式为C15H22O5,故B错误;
C.含有碳碳双键,可发生加成、加聚和氧化反应,含有醛基,可发生含有反应,故C正确;
D.由球棍模型可知含有醛基,可发生银镜反应,故D错误.
故选C.
【考点精析】根据题目的已知条件,利用有机物的结构和性质的相关知识可以得到问题的答案,需要掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解.

 阅读快车系列答案
阅读快车系列答案【题目】工业上制备 BaCl2·2H2O 有如下两种途径。
途径 1:以重晶石(主要成分 BaSO4)为原料,流程如下:

(1)写出“高温焙烧”时反应的化学方程式: _____________________________________。
(2)“高温焙烧” 时必须加入过量的炭,同时还要通入空气,其目的是____________。
途径 2:以毒重石(主要成分 BaCO3,含 Ca2+、 Mg2+、 Fe3+等杂质)为原料,流程如下:

已知: Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的 pH | 13.9 | 11.1 | 3.7 |
(3)为提高矿石的浸取率,可采取的措施是_________。
(4)加入 NH3·H2O 调节 pH=8 可除去____ (填离子符号),滤渣Ⅱ中含_________(填化学式)。加入 H2C2O4时应避免过量,原因是_________。
(5)重量法测定产品纯度的步骤为:
准确称取 m g BaCl2·2H2O 试样,加入 100 mL 水, 用 3 mL 2 mol·L-1 的 HCl 溶液加热溶解。边搅拌,边逐滴加入 0.1 mol·L-1 H2SO4 溶液。待 BaSO4 完全沉降后,过滤,用0.01 mol·L-1 的稀H2SO4洗涤沉淀 3~4 次,直至洗涤液中不含 Cl-为止。将沉淀置于坩埚中经烘干灼烧至恒重,称量为 n g。则BaCl2·2H2O的质量分数为_________。
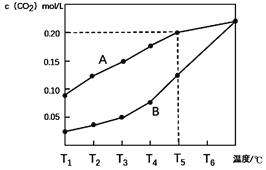
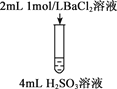
【题目】下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论不正确的是
实验① | 实验② | 实验③ |
|
|
|
A. 实验①中生成的沉淀是BaCO3
B. 实验①中有气体生成
C. 实验②沉淀中可能含有BaSO4
D. 实验③生成沉淀的离子方程式是:Ba2++ H2SO3===BaSO3↓+2H+