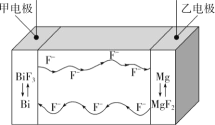
题目内容
【题目】A、B、C、D四种元素,A单质在B单质中燃烧发出苍白色火焰,C单质跟A、D形成的化合物的水溶液反应生成A单质,C原子与B原子的电子层相同,且最外层电子数之差为奇数,D原子最外层电子数为K层电子数的3倍,其单质为淡黄色固体。
(1)四种元素符号为A_________,B_________,C_________,D_________;
(2)离子的电子层结构相同的二种元素是_________,离子的结构示意图分别为_________、_________;
(3)四种元素中能形成AB型共价化合物的元素是__,由它们的同位素原子形成的AB型分子共有___,其中质量数最小的一种分子可用同位 素符号表示为_____。
【答案】H Cl Mg S Cl、S 
 Cl 6种
Cl 6种 ![]()
![]()
【解析】
氯气在氢气中燃烧产生苍白色火焰、单质为淡黄色的为S,C原子与B原子的电子层数相同,说明B为Cl,A为H。A、D形成的化合物为H2S,C为第三周金属元素,Cl的最外层电子数为7,再结合条件推出C为Mg。
(1)通过以上分析知,A、B、C、D分别是H、Cl、Mg、S元素;
(2)H离子核外没有电子,Cl、S简单离子核外电子数是18,镁离子核外电子数是10,所以离子的电子层结构相同的两种元素是Cl、S,其离子结构示意图分别为 、
、 ;
;
(3)HCl为AB型分子,H元素有3种同位素分别是![]() 、
、![]() 、
、![]() ,Cl元素有2种同位素:
,Cl元素有2种同位素:![]() 、
、![]() ,这些同位素可形成6种分子,其中
,这些同位素可形成6种分子,其中![]()
![]() 质量数最小;
质量数最小;

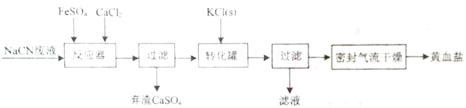
【题目】工业上用粗CuO粉末(含有Fe2O3和FeO杂质)制备纯净的CuCl2·xH2O晶体。
有关金属离子开始沉淀和沉淀完全时溶液的pH
离子 | Cu2+ | Fe2+ | Fe3+ |
开始沉淀pH | 5.4 | 8.1 | 2.7 |
沉淀完全pH | 6.9 | 9.6 | 3.7 |
制备方法如下:
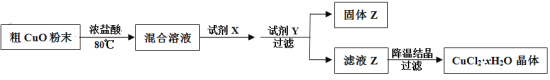
(1)加入试剂X的目的是将Fe2+氧化为Fe3+,试剂X是_______。
(2)加入试剂Y的目的是调节溶液的pH,试剂Y是______,调节pH的范围是_____,生成的固体Z是________。