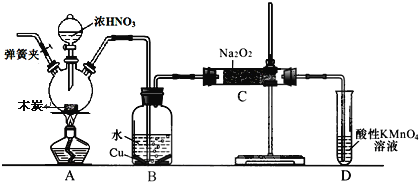
题目内容
【题目】工业上用粗CuO粉末(含有Fe2O3和FeO杂质)制备纯净的CuCl2·xH2O晶体。
有关金属离子开始沉淀和沉淀完全时溶液的pH
离子 | Cu2+ | Fe2+ | Fe3+ |
开始沉淀pH | 5.4 | 8.1 | 2.7 |
沉淀完全pH | 6.9 | 9.6 | 3.7 |
制备方法如下:
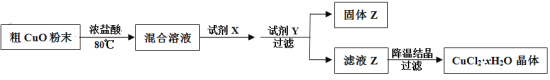
(1)加入试剂X的目的是将Fe2+氧化为Fe3+,试剂X是_______。
(2)加入试剂Y的目的是调节溶液的pH,试剂Y是______,调节pH的范围是_____,生成的固体Z是________。
【答案】Cl2 CuO或Cu(OH)2 3.7≤pH<5.4 Fe(OH)3
【解析】
粗CuO粉末(含有Fe2O3和FeO杂质)用浓盐酸溶解,反应后得到含有CuCl2、FeCl3、FeCl2的混合溶液,然后向其中加入氧化剂,可以将FeCl2氧化为FeCl3,再向溶液中加入CuO或Cu(OH)2或Cu2(OH)2CO3,调节溶液的pH使Fe3+形成Fe(OH)3沉淀,而Cu2+仍然以离子形式存在于溶液中,通过结晶方法获得CuCl2晶体。
(1)加入试剂X的目的是将Fe2+氧化为Fe3+,同时又不能引入新的杂质,试剂X是可以是Cl2或H2O2。
(2)加入试剂Y可以消耗溶液中H+,提高溶液的pH,通过调节溶液的pH,使杂质Fe3+形成Fe(OH)3沉淀除去,试剂Y可以是CuO或Cu(OH)2或Cu2(OH)2CO3,调节的溶液的pH,此时Cu2+仍然以Cu2+离子形式存在于溶液中,根据Fe3+、Cu2+开始形成沉淀和沉淀完全的pH数值,可知溶液的pH的范围是3.7≤pH<5.4,生成的固体Z是Fe(OH)3。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案【题目】煤燃烧排放的烟气含有SO2和NOx(主要成分为NO、NO2的混合物),对烟气进行脱硫、脱硝有多种方法。
(1)碱液吸收法:采用石灰乳脱除SO2.脱除后的主要产物是_____。
(2)液相氧化法:采用 NaClO溶液进行脱除。
①NaClO水解的离子方程式是_____。
②NaClO溶液吸收NO的主要过程如下
i.NO(aq)+HClO(aq)NO2(aq)+HCl(aq) △H1
ii.3NO2(aq)+H2O(1)2HNO3(aq)+NO(aq) △H2
NO(aq)转化为HNO3(aq)的热化学方程式是_____。
③研究pH对NO脱除率的影响。调节 NaClO溶液的初始pH,NO的脱除率如表:
初始pH | 3.5 | 4.5 | 5.5 | 6.5 | 7.5 |
NO脱除率 | 91% | 88% | 83% | 65% | 51% |
pH影响NO脱除率的原因是_____。
(3)研究发现,在液相氧化法中,一定量的SO2能提高NOx的脱除率。当pH=5.5时,SO2对有效氯含量、NOx脱除率的影响如图所示。
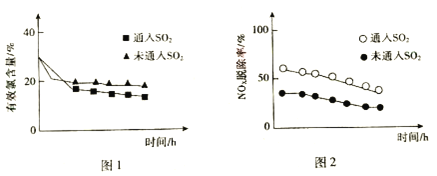
①据图1,通入SO2后有效氯含量降低。SO2和HClO反应的离子方程式是_____。
②针对图2中NOx脱除率提高的原因,研究者提出了几种可能发生的反应:
A.SO2+2NO+H2O═N2O+H2SO4
B.2SO2+2NO+2H2O═N2+2H2SO4
C.4SO2+2NO2+4H2O═N2+4H2SO4
用同位素示踪法确认发生的反应:把15NO2和NO按一定比例混合,通入SO2的水溶液中,检测气体产物。
a.气体产物中主要含有15NO2、N2O,则发生的主要反应是_____(填序号)。
b.同时检测到气体产物中还有15N N,产生15N N的化学方程式是_____。