题目内容
【题目】用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是
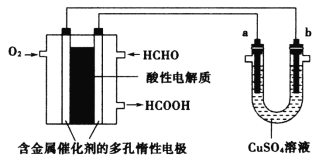
A.燃料电池工作时,负极反应为HCHO+H2O-4e-=CO2+4H+
B.当燃料电池消耗2.24L甲醛气体时,电路中理论上转移0.2mole-
C.当a、b都是铜电极时,电解的总反应方程式为:2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑
2H2SO4+2Cu+O2↑
D.电解后,消耗的甲醛和a电极上析出物质的物质的量相等
【答案】D
【解析】
由图可知左侧为甲醛燃料电池,燃料HCHO由负极通入,失电子,发生氧化反应,电极反应为:HCHO+H2O-2e-=HCOOH+2H+,氧化剂O2由正极通入,得到电子发生还原反应,电极反应为:O2+4e-+4H+=2H2O;右侧为电解池,与电源正极相连的b为电解池的阳极,失去电子发生氧化反应,与电源负极相连的a为电解池的阴极,得到电子发生还原反应,电极反应为:Cu2++2e-=Cu,据此分析解答。
A. 由分析可知,燃料HCHO由负极通入,失电子,发生氧化反应,电极反应为:HCHO+H2O-2e-=HCOOH+2H+,A项错误;
B. 燃料电池中HCHO在负极上失电子,电极反应为HCHO+H2O-2e-=HCOOH+2H+,由于不一定处于标准状况下,因此2.24L甲醛气体的物质的量无法计算,不能进一步计算电路中理论上转移的电子的物质的量,B项错误;
C. 当a、b都是铜电极时,该装置为电解精炼铜的装置,阳极上铜失电子,电极反应为Cu-2e-=Cu2+,阴极上铜得电子Cu2++2e-=Cu,C项错误;
D. 原电池的负极反应为:HCHO+H2O-2e-=HCOOH+2H+,电解池阴极的反应为:Cu2++2e-=Cu,根据电子守恒可知消耗的甲醛和a电极上析出物质的物质的量相等,D项正确;
答案选D。