题目内容
16. 能源与材料、信息一起被称为现代社会发展的三大支柱,现代社会的一切活动都离不开能源,能源的利用与相互转化始终与我们息息相关.
能源与材料、信息一起被称为现代社会发展的三大支柱,现代社会的一切活动都离不开能源,能源的利用与相互转化始终与我们息息相关.(1)已知反应X+Y═M+N的能量变化如图所示,该反应为吸热反应(填“放热”或“吸热”).
(2)研究表明,在一定温度和压强条件下,2molH2(g)和1molO2(g)完全化合成2molH2O(g)所放出的热量:①与在相同条件下2molH2O(g)完全分解为2molH2(g)和1molO2(g)所吸收的热量在数值上相等;②是相同条件下1molH2(g)和0.5molO2(g)完全化合成1molH2O(g)所放出热量的2倍;③比在相同条件下2molH2(g)和1molO2(g)完全化合成2molH2O(g)所放出的热量少.则下列说法正确的是ABCD.
A.一个化学反应其正、逆反应的能最变化,在数值上相等,吸收与放出相反
B.一个化学反应的能量变化与其反应物的物质的量有关
C.一个化学反应的能量变化与其反应物、生成物的状态有关
D.一个化学反应的能量变化与其反应物的物质的量有关且成正比例关系.
分析 (1)根据能量图可知反应物总能量小于生成物总能量,则该反应为吸热反应;
(2)由2molH2(g)和1molO2(g)完全化合成2molH2O(g)所放出的热量与在相同条件下2molH2O(g)完全分解为2molH2(g)和1molO2(g)所吸收的热量在数值上相等,则一个化学反应其正、逆反应的能最变化,在数值上相等,吸收与放出相反;
2molH2(g)和1molO2(g)完全化合成2molH2O(g)所放出的热量是相同条件下1molH2(g)和0.5molO2(g)完全化合成1molH2O(g)所放出热量的2倍,则一个化学反应的能量变化与其反应物的物质的量有关且成正比例关系;
2molH2(g)和1molO2(g)完全化合成2molH2O(g)所放出的热量比在相同条件下2molH2(g)和1molO2(g)完全化合成2molH2O(g)所放出的热量少,则一个化学反应的能量变化与其反应物、生成物的状态有关.
解答 解:(1)根据能量图可知反应物总能量小于生成物总能量,则该反应为吸热反应,故答案为:吸热;
(2)由2molH2(g)和1molO2(g)完全化合成2molH2O(g)所放出的热量与在相同条件下2molH2O(g)完全分解为2molH2(g)和1molO2(g)所吸收的热量在数值上相等,则一个化学反应其正、逆反应的能最变化,在数值上相等,吸收与放出相反,故A正确;
2molH2(g)和1molO2(g)完全化合成2molH2O(g)所放出的热量是相同条件下1molH2(g)和0.5molO2(g)完全化合成1molH2O(g)所放出热量的2倍,则一个化学反应的能量变化与其反应物的物质的量有关且成正比例关系,故BD正确;
2molH2(g)和1molO2(g)完全化合成2molH2O(g)所放出的热量比在相同条件下2molH2(g)和1molO2(g)完全化合成2molH2O(g)所放出的热量少,则一个化学反应的能量变化与其反应物、生成物的状态有关,故C正确;
故选:ABCD.
点评 本题主要考查了化学反应与能量的关系以及热化学方程式的意义,难度不大,注意一个化学反应的能量变化与其反应物的物质的量有关且成正比例关系,其正、逆反应的能最变化,在数值上相等,吸收与放出相反.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 标准状况下,22.4L乙醇所含的分子数为NA | |
| B. | 1mol/LCaCl2溶液中含有的氯离子数目为2NA | |
| C. | 1 mol金属钠在足量氧气中完全燃烧转移的电子数为2NA | |
| D. | 28g N2中含有的原子数为2NA |
| A. | 反应物的总能量一定低于生成物的总能量 | |
| B. | 所有的中和反应都为放热反应 | |
| C. | 破坏反应物中的化学键所吸收的总能量大于形成生成物中化学键所放出的总能量 | |
| D. | 放热反应,不必加热就可发生 |
| X | ||||
| Y | Z | |||
| W |
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | Y、Z的氢化物有可能含非极性键 | |
| C. | Z、W形成的化合物W显负价 | |
| D. | Y分别与Z、W形成的化合物全部都是非极性分子 |
| A. | 对反应体系加热 | B. | 改用体积大的反应容器 | ||
| C. | 加入少量硫酸铜溶液 | D. | 改用铁粉代替铁片 |
| A. | 碳酸钠和碳酸氢钠均可用作食用碱 | B. | 液氮可用作制冷剂 | ||
| C. | 二氧化硫可用于食品增白 | D. | 漂粉精可用于环境杀菌消毒 |
 1834年,德国科学家米希尔里希通过蒸馏苯甲酸和石灰的混合物,得到了鱼法拉第所制液体相同的一种液体,并命名为苯.后来,法国化学家热拉尔等人又确定了苯的分子式为C6H6.
1834年,德国科学家米希尔里希通过蒸馏苯甲酸和石灰的混合物,得到了鱼法拉第所制液体相同的一种液体,并命名为苯.后来,法国化学家热拉尔等人又确定了苯的分子式为C6H6.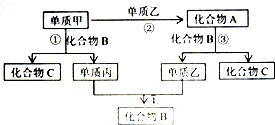 甲、乙、丙是三种常见单质,A、B、C是常见化合物,B在常温下为液态.在一定条件下上述物质之间的关系如图.
甲、乙、丙是三种常见单质,A、B、C是常见化合物,B在常温下为液态.在一定条件下上述物质之间的关系如图. 氧化-还原反应是中学化学中一类重要的反应类型,在日常生活中很常见,请回答:(1)在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中.当产生标况下4.48L气体时,消耗单质铜19.2g,此时转移了0.6mol电子.
氧化-还原反应是中学化学中一类重要的反应类型,在日常生活中很常见,请回答:(1)在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中.当产生标况下4.48L气体时,消耗单质铜19.2g,此时转移了0.6mol电子.