题目内容
7.对于放热反应,下列说法中正确的是( )| A. | 反应物的总能量一定低于生成物的总能量 | |
| B. | 所有的中和反应都为放热反应 | |
| C. | 破坏反应物中的化学键所吸收的总能量大于形成生成物中化学键所放出的总能量 | |
| D. | 放热反应,不必加热就可发生 |
分析 A、放热反应中的反应物的总能量大于生成物的总能量;
B、酸碱中和反应为放热反应;
C、反应中断键时吸收的能量比形成化学键时放出的能量高,则反应是吸热反应;
D、很多放热反应,也必须加热才能发生.
解答 解:A、放热反应中的反应物的总能量大于生成物的总能量,反应物的能量在反应过程中剩余,会以热量的形式放出,即为放热反应,故A错误;
B、酸碱中和反应中的反应物的总能量一定大于生成物的总能量,故酸碱中和反应均为放热反应,故B正确;
C、对于放热反应,应为破坏反应物中的化学键所吸收的总能量小于形成生成物中化学键所放出的总能量,故C错误;
D、很多放热反应,也必须加热才能发生,如煤炭的燃烧,故D错误.
故选B.
点评 本题考查化学反应的条件与化学反应的热效应间的关系,难度不大,需正确理解放热吸热的本质是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.硒(Se)是人体必需的微量元素,它的一种同位素是${\;}_{34}^{80}$Se.下列有关该同位素的说法止确的是( )
| A. | 质子数为80 | B. | 中子数为46 | C. | 电子数为114 | D. | 质量数为34 |
10.下列各组中的两种有机物一定互为同系物的是( )
| A. | CH4O和C2H6O | B. | C2H4和C6H12 | C. | C2H2和C4H6 | D. | CH4和C3H8 |
7.n摩某金属R与足量盐酸反应,生成RClx和标准状况下V升氢气,则x值为( )
| A. | 11.2nV | B. | $\frac{V}{11.2n}$ | C. | 22.4nV | D. | $\frac{n}{22.4V}$ |
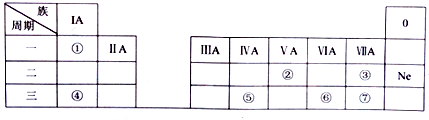
2.在探索生命奥秘的过程中,科学家们日益认识到生命细胞的组成和元素周期律有着密切的关系,约占人体总质量99.97%的11种宏量元素,全部位于周期表前20号元素之内,它们在元素周期表中的位置如下:
在a~k11种元素中:
(1)写出a、e、g的元素符号:aH、eNa、gP.
(2)原子最外层电子数是最内层电子数2倍的是C,原子半径最大的是K,最高价氧化物对应水化物酸性最强的元素是Cl.
(3)剩余的元素中,离子电子层结构相同,且带电量也相同,但电性相反的两种元素是O和Mg.(以上各空均填元素符号)
(4)写出c元素单质的电子式: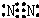 .
.
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 一 | a | ||||||
| 二 | b | c | d | ||||
| 三 | e | f | g | h | i | ||
| 四 | j | k | |||||
(1)写出a、e、g的元素符号:aH、eNa、gP.
(2)原子最外层电子数是最内层电子数2倍的是C,原子半径最大的是K,最高价氧化物对应水化物酸性最强的元素是Cl.
(3)剩余的元素中,离子电子层结构相同,且带电量也相同,但电性相反的两种元素是O和Mg.(以上各空均填元素符号)
(4)写出c元素单质的电子式:
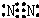 .
.
19.在100kPa时,1mol石墨转化为金刚石,需吸收1.895kJ的能量.下列结论正确的是( )
| A. | 金刚石与石墨都是由碳元素组成的,两者互为同位素 | |
| B. | 金刚石与石墨在足量的氧气中燃烧,所得产物相同,放出的热量也可能相等 | |
| C. | 金刚石比石墨稳定 | |
| D. | 1mol石墨比1mol金刚石的总能量高 |
17.下列溶液中,溶质的物质的量浓度为1mol•L-1的是( )
| A. | 将40gNaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 将80gSO3溶于水并配成1L的溶液 | |
| C. | 将0.5mol•L-1的NaNO3溶液100ml 加热蒸发掉50g水后的溶液 | |
| D. | 1L含K+为1mol的K2SO4溶液 |
 能源与材料、信息一起被称为现代社会发展的三大支柱,现代社会的一切活动都离不开能源,能源的利用与相互转化始终与我们息息相关.
能源与材料、信息一起被称为现代社会发展的三大支柱,现代社会的一切活动都离不开能源,能源的利用与相互转化始终与我们息息相关.