题目内容
2.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )| A. | 原子半径:A<B<C<D<E | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 金属性:D>C | |
| D. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应 |
分析 A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素B的原子最外层电子数是其电子层数的2倍,B元素后多种短周期主族元素,所以B有2个电子层,最外层电子数为4,故B为C元素;
元素C在同周期的主族元素中原子半径最大,处于IA族,原子序数大于碳,则C为Na元素;
元素D的合金是日常生活中常用的金属材料,则D为Al;
元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素;
E的原子序数大于铝元素,E为Cl元素,据此解答.
解答 解:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素B的原子最外层电子数是其电子层数的2倍,B元素后多种短周期主族元素,所以B有2个电子层,最外层电子数为4,故B为C元素;
元素C在同周期的主族元素中原子半径最大,处于IA族,原子序数大于碳,则C为Na元素;
元素D的合金是日常生活中常用的金属材料,则D为Al;
元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素;
E的原子序数大于铝元素,E为Cl元素,
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:Na>Al>Cl>C>H,即原子半径A<B<E<D<C,故A错误;
B.化合物AE是HCl,属于共价化合物,含有共价键;化合物CE是NaCl,属于离子化合物,含有离子键,二者含有的化学键类型不同,故B错误;
C.同周期自左而右金属性减弱,故金属性Na>Al,故C错误;
D.元素C的最高价氧化物对应的水化物是氢氧化钠、D的最高价氧化物对应的水化物是氢氧化铝,氢氧化铝与氢氧化钠反应生成偏铝酸钠,故D正确;
故选D.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题的关键,注意掌握原子半径比较、金属性与非金属性强弱比较方法.

练习册系列答案
相关题目
13.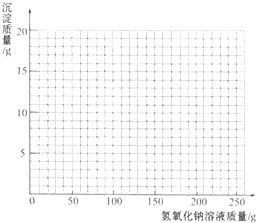 烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
(1)得到沉淀的总质量为9.8g,该混合溶液中硫酸铜的质量为16g.
(2)参加反应的NaOH溶液的总质量是多少克?
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线.
 烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:| 加入NaOH溶液的质量/g | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
| 生成沉淀的质量/g | 0.0 | 2.5 | 8.6 | 9.8 | 9.8 |
(2)参加反应的NaOH溶液的总质量是多少克?
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线.
10.用NaOH固体配制一定物质的量浓度的NaOH溶液时,不需要使用的玻璃仪器是( )
| A. | 玻璃棒 | B. | 容量瓶 | C. | 圆底烧瓶 | D. | 胶头滴管 |
17.下列过程不能实现化学能转化为热能的是( )
| A. | 碳酸钙受热分解 | B. | 乙烷燃烧 | ||
| C. | 铝粉与四氧化三铁反应 | D. | 铁与盐酸反应 |
7.为纪念俄国化学家门捷列夫,人们把第101号元素(人工合成元素)命名为钔.该元素最稳定的一种原子为${\;}_{101}^{258}$Md,关于该原子下列说法正确的是( )
| A. | 质子数是258 | B. | 质量数是101 | C. | 中子数是157 | D. | 电子数是359 |
14.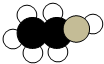 如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )
如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )
 如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )
如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )| A. | 能使紫色石蕊变红 | B. | 能与Na2CO3反应 | ||
| C. | 能发生酯化反应 | D. | 不能发生氧化反应 |
11. 日本一家公司日前宣布,他们已经开发并计划大量生产一种颠覆性的阳极和阴极都是碳材料的双碳性电池(放电原理示意如图所示),充电速度比普通的锂离子电池快20倍.放电时,正极反应Cn(PF6)+e-═PF6-+nC,负极反应LiCn-e-═Li++nC下列有关说法中正确的是( )
日本一家公司日前宣布,他们已经开发并计划大量生产一种颠覆性的阳极和阴极都是碳材料的双碳性电池(放电原理示意如图所示),充电速度比普通的锂离子电池快20倍.放电时,正极反应Cn(PF6)+e-═PF6-+nC,负极反应LiCn-e-═Li++nC下列有关说法中正确的是( )
 日本一家公司日前宣布,他们已经开发并计划大量生产一种颠覆性的阳极和阴极都是碳材料的双碳性电池(放电原理示意如图所示),充电速度比普通的锂离子电池快20倍.放电时,正极反应Cn(PF6)+e-═PF6-+nC,负极反应LiCn-e-═Li++nC下列有关说法中正确的是( )
日本一家公司日前宣布,他们已经开发并计划大量生产一种颠覆性的阳极和阴极都是碳材料的双碳性电池(放电原理示意如图所示),充电速度比普通的锂离子电池快20倍.放电时,正极反应Cn(PF6)+e-═PF6-+nC,负极反应LiCn-e-═Li++nC下列有关说法中正确的是( )| A. | a极为电池的负极 | |
| B. | A-为OH- | |
| C. | 电池充电时阴极反应为:LiCn+e-═Li++nC | |
| D. | 充电时,溶液中A-从b极向a极迁移 |