题目内容
2.下列化学用语描述中不正确的是( )| A. | 中子数为20的氯原子:${\;}_{17}^{37}Cl$ | |
| B. | K2O的电子式: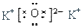 | |
| C. | HCO3-的电离方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | 比例模型 可以表示CO2分子或SiO2 可以表示CO2分子或SiO2 |
分析 A.质量数=质子数+中子数,元素符号的左上角不是质量数、左下角不是质子数;
B.氧化钾为离子化合物,阴阳离子都需要标出电荷,氧离子还需要标出最外层电子;
C.碳酸氢根离子的电离产生水合氢离子和碳酸根离子;
D.二氧化硅属于原子晶体,不存在二氧化硅分子.
解答 解:A.元素符号的左上角标质量数,中子数为20的氯原子的质量数为37,该核素的表示方法为:${\;}_{17}^{37}Cl$,故A正确;
B.氧化剂为离子化合物,钾离子直接用离子符号表示,氧离子需要标出所带电荷及最外层电子,氧化钾的电子式为: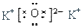 ,故B正确;
,故B正确;
C.碳酸氢根离子在溶液中电离出水合氢离子和碳酸根离子,HCO3-的电离方程式为:HCO3-+H2O?CO32-+H3O+,故C正确;
D. 可以表示二氧化碳的比例模型,但是不能表示二氧化硅,因为二氧化硅晶体为原子晶体,不存在二氧化硅分子,故D错误;
可以表示二氧化碳的比例模型,但是不能表示二氧化硅,因为二氧化硅晶体为原子晶体,不存在二氧化硅分子,故D错误;
故选D.
点评 本题考查了常见化学用语的书写方法判断,题目难度中等,涉及原子符号、电离方程式、结构式等知识,试题涉及的知识点较多,注意掌握常见的化学用语的概念及正确的表示方法.

练习册系列答案
相关题目
12.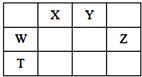 如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
 如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质WY2、W3X4均有熔点高、硬度大的特性 | |
| D. | T元素的单质不具有半导体的特性,T与Z元素可形成化合物TZ4 |
13.下列反应中,既属于氧化还原反应,又是吸热反应的是( )
| A. | NaOH与HCl的反应 | B. | 灼热的碳与二氧化碳的反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl的反应 | D. | 酒精在空气中的燃烧反应 |
10.1919年,科学家第一次实现了人类多年的梦想-人工转变元素.这个核反应如下:7N+2He→8O+1H.下列叙述正确的是( )
| A. | 氧的一种核素符号是8O | |
| B. | 1H原子核内有1个中子 | |
| C. | O2和O3互为同位素 | |
| D. | 通常情况下,He和N2化学性质都很稳定 |
17.下列叙述正确的是( )
| A. | 在一定条件下通入氢气发生反应,可除去乙烷中混有的乙烯 | |
| B. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 | |
| C. |  的一氯代物有4种 的一氯代物有4种 | |
| D. | 甲醛溶液与足量的银氨溶液共热的离子反应方程式为:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O |
7.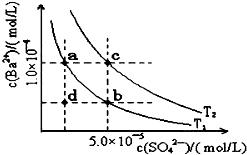 已知BaSO4(s)?Ba2+(aq)+SO4 2-(aq),25℃时Ksp=1.07×10-10,且BaSO4的随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是( )
已知BaSO4(s)?Ba2+(aq)+SO4 2-(aq),25℃时Ksp=1.07×10-10,且BaSO4的随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是( )
 已知BaSO4(s)?Ba2+(aq)+SO4 2-(aq),25℃时Ksp=1.07×10-10,且BaSO4的随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是( )
已知BaSO4(s)?Ba2+(aq)+SO4 2-(aq),25℃时Ksp=1.07×10-10,且BaSO4的随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是( )| A. | 温度为T1时,在T1曲线上方区域任意一点时,均有BaSO4沉淀生成 | |
| B. | 蒸发溶剂可能使溶液由d点变为T1曲线上a、b之间的某一点 | |
| C. | 升温可使溶液由b点变为d点 | |
| D. | T2>25℃ |
14.链式炔碳…-C≡C-C≡C-C≡C…是现已发现的碳的第四种同素异形体,已知链式炔碳C300经过适当的处理可得含多个-C≡C-(不含-C≡C-)的链状化合物C300H302,则该分子中含-C≡C-的数目为( )
| A. | 73 | B. | 74 | C. | 75 | D. | 76 |
11.下列离子方程式正确的是( )
| A. | 铁粉加入三氯化铁溶液中 Fe+Fe3+═2Fe2+ | |
| B. | Cl2与水的反应Cl2+H2O═2H++Cl-+ClO- | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 大理石溶于醋酸的反应CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
12. 某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
 某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )| A. | 反应开始至2min,Z的反应速率为0.10mol•L-1•min-1 | |
| B. | 该反应的化学方程式为3X+Y?2Z | |
| C. | 2min时,反应达最大限度,但化学反应仍在进行 | |
| D. | 反应达到平衡时,压强是开始时的0.9倍 |