题目内容
【题目】某盐的组成可表示为3[H3ON5]:3[NH4N3]·NH4Cl。回答下列问题
(1)氯原子的电子排布式为________________________.
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_____________;氮元素的E1呈现异常的原因是_____________。
(3)经X射线衍射测得化合物3[H3ON5]·3NH4N5]·NH4Cl的晶体结构,其局部结构如图(b)所示
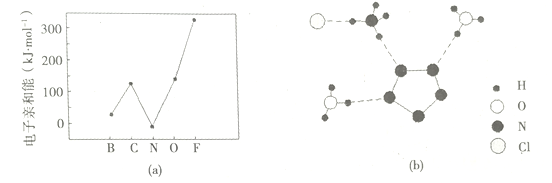
①H3O+中心原子的杂化类型为___________,NH4+的空间构型为_________。
②3[H3ON5]·3[NH4N5]·NH4C1中阴离子N5-中的![]() 键总数为______个。分子中的大
键总数为______个。分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大键的原子数,n代表参与形成大键的电子数(如苯分子中的大
表示,其中m代表参与形成大键的原子数,n代表参与形成大键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则N5-中的大
),则N5-中的大![]() 键应表示为____________________。
键应表示为____________________。
③图(b)中虚线代表氢键,其中表示式为(NH4)N一H……Cl、_______、______。
(4)3[H3ON5]·3[NH4N5]·NH4Cl的晶体密度为dg.cm-3,其立方晶胞参数为a nm,晶胞中含有y个3[H3ON5]·3[NH4N5]·NH4Cl单元,该单元的相对质量为M,则y的计算表达式为________.
【答案】 1s22s22p63s23p5 同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量(E1)依次增大 N原子的2p轨道为半充满状态,具有额外稳定性,故不易结合一个电子 sp3杂化 正四面体 5 ![]() (H3O+)O—H…N(N
(H3O+)O—H…N(N![]() ) (NH
) (NH![]() )N—H…N(N
)N—H…N(N![]() )
) ![]() (或:
(或:![]() ×10-21)
×10-21)
【解析】(1)氯原子的核电荷数为17,其电子排布式为1s22s22p63s23p5 ;正确答案:1s22s22p63s23p5。
(2)同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合1个电子释放出的能量依次增大,氮原子的2p轨道为半充满状态,具有稳定性;正确答案:同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量(E1)依次增大;N原子的2p轨道为半充满状态,具有额外稳定性,故不易结合一个电子。
(3)①H3O+中价层电子对个数都是3且含有一对孤电子对,所以为三角锥形结构,中心原子的杂化类型为sp3杂化,NH4+中价层电子对个数是4且不含孤电子对,其空间构型为正四面体;正确答案:sp3;正四面体。
②如图2所示,3[H3ON5]·3[NH4N5]·NH4C1中阴离子N5-中的![]() 键总数为5个,根据已知信息,N5-中参与形成大
键总数为5个,根据已知信息,N5-中参与形成大![]() 键的原子数且5,形成大
键的原子数且5,形成大![]() 键的电子数为6,所以N5-中的大
键的电子数为6,所以N5-中的大![]() 键表示为
键表示为![]() ;正确答案:5;
;正确答案:5; ![]() 。
。
③图(b)中虚线代表氢键,其中表示式为(NH4)N一H……Cl、(H3O+)O—H…N(N![]() ) 、(NH
) 、(NH![]() )N—H…N(N
)N—H…N(N![]() ) ;正确答案:(H3O+)O—H…N(N
) ;正确答案:(H3O+)O—H…N(N![]() ) 、(NH
) 、(NH![]() )N—H…N(N
)N—H…N(N![]() ) 。
) 。
(4)晶胞体积V=(a×10-7)3cm3, 晶胞质量为m=y×M/NA,密度为ρ=m/V,所以y=![]() ×10-21;正确答案:
×10-21;正确答案:![]() (或:
(或:![]() ×10-21)。
×10-21)。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,在工业上有重要的用途。
(1)已知:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H1;
2ClNO(g)+H2O(g)=NO(g)+2HCl(g ) △H2。
则反应:4ClNO(g)+O2(g)=2Cl2(g)+2N2O3(g)的△H=_______(用含△H1、△H2 的代数式表示 )。
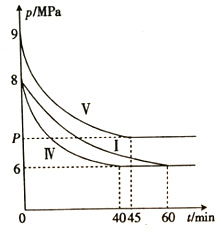
(2)将NO与Cl2按物质的量之比2:1充入一绝热密闭容器中,发生反应:
2NO(g)+Cl2(g) ![]() 2ClNO(g) △H<0,实验测得NO的转化率α(NO)随时间的变化如图所示。
2ClNO(g) △H<0,实验测得NO的转化率α(NO)随时间的变化如图所示。
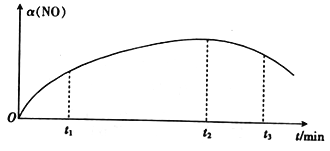
NO(g)的转化率α(NO)在t2~t3时间段内降低的原因是___________。
(3)在其他条件相同时,向五个恒温恒容的密闭容器中分别充入1mol Cl2 与2 mol NO,发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0,部分反应条件及平衡时Cl2 的转化率如下表所示。
2ClNO(g) △H<0,部分反应条件及平衡时Cl2 的转化率如下表所示。
容器编号 | 温度/℃ | 容器体积/L | 平衡时Cl2 的转化率 |
I | T1 | 2 | 75% |
II | T2=T1 | 3 | ω2 |
Ⅲ | T3>T1 | V3 | 75 % |
Ⅳ | T4 | V4 | ω4 |
V | T5 | V5 | ω5 |
①6 min时容器I中反应达到平衡,则0~6 min内,v(NO)=______mol·L-l·min-1。
②V3______(填“ > ”“<”或“ = ”) 2。
③容器I中反应的平衡常数的值K2=______,容器Ⅲ中反应的平衡常数的值K3=_____(填“>”“<”或“=”)K2。
④容器Ⅳ、容器V分别与容器I相比只有一个实验条件不同,反应体系总压强随时间的变化如图所示。与容器I相比,容器Ⅳ改变的实验条件是_______;容器V与容器I 的体积不同,则容器V中反应达到平衡时气体总压强(P)的范围是________。