��Ŀ����
����Ŀ��ú������Ҫ�ĺ���������H2S�Լ�COS���л���ú��ȼ�պ������ʻ�ת����SO2�Ӷ����������Ⱦ�����ú����H2S���ѳ��̶��ѳ�Ϊú���ྻ�ȵ�һ����Ҫָ�ꡣ��ش���������:
��1��H2S��ˮ��Һ�еĵ��뷽��ʽΪ___________��
��2���ѳ�ú����COS�ķ�����Br2��KOH��Һ��������H2��ԭ����ˮ�ⷨ�ȡ�
��COS�ķ��ӽṹ��CO2���ƣ�COS�ĽṹʽΪ___________��
��Br2��KOH��Һ��COS����Ϊ�����ε����ӷ���ʽΪ______________��
����֪��H2��COS��H2S��CO��ȼ��������Ϊ285kJ/mol��299kJ/mol��586kJ/mol��283kJ/mol��H2��ԭCOS�����ķ�ӦΪH2(g)+COS(g)=H2S(g)+CO(g)���÷�Ӧ�Ħ�H=_________kJ/mol��
���û��Ԧ�-Al2O3��COSˮ�ⷴӦΪCOS(g)+H2O(g) ![]() CO2(g)+H2S(g) ��H<0����ͬ�������ڴ�������ͣ����ͬʱ��ʱ����ͬ�¶���COS��ת���ʣ�δ�ﵽƽ�⣩��ͼ1��ʾ��ij�¶��£�COS��ƽ��ת������n(H2O)/n(COS)�Ĺ�ϵ��ͼ2��ʾ��
CO2(g)+H2S(g) ��H<0����ͬ�������ڴ�������ͣ����ͬʱ��ʱ����ͬ�¶���COS��ת���ʣ�δ�ﵽƽ�⣩��ͼ1��ʾ��ij�¶��£�COS��ƽ��ת������n(H2O)/n(COS)�Ĺ�ϵ��ͼ2��ʾ��
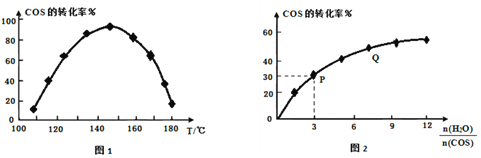
��ͼ1��֪�������������ʱ��Ӧ���¶�ԼΪ______��COS��ת�����ں����½���ԭ����_______________________________________����ͼ2��֪��P��ʱƽ�ⳣ��K=______������2λ��Ч���֣���Q��ת���ʸ���P���ԭ����__________________________________��
���𰸡� H2S![]() H++HS- ��HS-
H++HS- ��HS-![]() H++S2- O=C=S COS+4Br2+12OH-=CO32-+SO42-+8Br-+6H2O 285 150 �����ж�����������Ӧ�Ⱥ����𰸣�ƽ�������ƶ��������һ�ɲ����֣� 0.048 ��ͬ������n(H2O)/n(COS)Խ�ߣ��൱��COSŨ�Ȳ�������£�����ˮ����Ũ�ȣ�ƽ�������ƶ���COSת�������
H++S2- O=C=S COS+4Br2+12OH-=CO32-+SO42-+8Br-+6H2O 285 150 �����ж�����������Ӧ�Ⱥ����𰸣�ƽ�������ƶ��������һ�ɲ����֣� 0.048 ��ͬ������n(H2O)/n(COS)Խ�ߣ��൱��COSŨ�Ȳ�������£�����ˮ����Ũ�ȣ�ƽ�������ƶ���COSת�������
��������(1) H2S��ˮ��Һ�������ᣬ�����ᣬ���ֲ����룬��H2S![]() H++HS- ��HS-
H++HS- ��HS-![]() H++S2-������ֻдH2S
H++S2-������ֻдH2S![]() H++HS-��
H++HS-��
(2) ��CO2�ķ��ӽṹ�Ǻ�C=O��ֱ�����ɣ�����COS�ķ��ӽṹʽΪS=C=O����Br2��KOH��Һ������COSʱ��������Br����S��������أ�C���ɵ�CO2�ڼ�����Һ��ת��ΪCO32-�����Է�Ӧ�����ӷ���ʽΪCOS+4Br2 +12OH��= CO32-+SO42-+8Br��+6H2O������������������ȼ���ȵ��Ȼ�ѧ����ʽ�����ø�˹���ɼ����������H=(285kJ/mol+299kJ/mol)-(586kJ/mol+283kJ/mol)=-285 kJ/mol������ͼ1��֪������ͬʱ���ڣ�ת�������ʱ���������������Ӧ���¶�Ϊ150�����¶ȹ��ߣ�ʹ������ѻ��Լ�����ɥʧ���������ж�������ת���ʼ�С����ͼ2��֪��P��ʱCOS��ת����Ϊ30%��n(H2O)/n(COS)=3���������¹�ϵ��
COS(g)+H2O(g) ![]() CO2(g)+H2S(g)
CO2(g)+H2S(g)
��ʼ���ʵ���(mol) 1 3 0 0
�ı����ʵ���(mol) 0.3 0.3 0.3 0.3
ƽ�����ʵ���(mol) 0.7 2.7 0.3 0.3
��K=![]()
��ͬ������n(H2O)/n(COS)�ı�ֵԽ�ߣ��൱��COSŨ�Ȳ�������£�����Ӧ��ˮ����Ũ�ȣ��ٽ���ѧƽ�������ƶ��������COSת���ʡ�

