题目内容
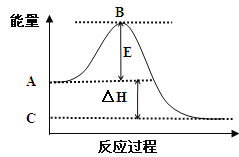
【题目】(1)2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
 请回答下列问题:
请回答下列问题:
①图中A点表示:
C点表示:
E的大小对该反应的反应热 (填“有”或“无”)影响。
②图中△H= kJ/mol。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) +1/2O2(g) = H2O( l )的ΔH = kJ/mol。氢气的燃烧热为ΔH = kJ/mol。
【答案】(1)①反应物的总能量;生成物的总能量;无;-198
(2)①H2 (g) +![]() O2 (g)=H2O ( g ) ΔH =―241.8 kJ/mol ;―286.8 ;―286.8
O2 (g)=H2O ( g ) ΔH =―241.8 kJ/mol ;―286.8 ;―286.8
【解析】(1)①根据图像可知,反应物总能量高于生成物总能量,所以该反应为放热反应,由此可知图中A点表示反应物的总能量;C点表示生成物的总能量;E表示活化能,活化能的大小对该反应的反应热无影响。
②图中表示的是2molSO2的反应,因此△H=-99×2="-198" kJ·mol-1;
(2)①氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量,则反应的热化学方程式
为H2 (g)+![]() O2 ( g )=H2O(g) ΔH =―241.8 kJ/mol;
O2 ( g )=H2O(g) ΔH =―241.8 kJ/mol;
②根据①H2 (g) +![]() O2 (g)=H2O(g) ΔH =―241.8 kJ/mol;②H2O(g)=H2O(l)
O2 (g)=H2O(g) ΔH =―241.8 kJ/mol;②H2O(g)=H2O(l)
△H= —45kJ/mol。氢气燃烧生成气态水时放出热量为241.8KJ,气态水生成液态水放出热量为45KJ,故氢气的燃烧热为286.8KJ。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案