题目内容
【题目】下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请根据原电池原理回答问题:
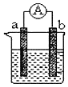
(1)若电极a为Zn、电极b为Cu、电解质溶液为稀硫酸,该装置工作时,SO42向_____极(填a或b)移动,正极的电极反应式为_______________________________。
(2)若电极a为Mg、电极b为Al、电解质溶液为氢氧化钠溶液,该原电池工作时,电子从_____极(填a或b)流出。一段时间后,若反应转移3NA个电子,则理论上消耗Al的质量是________g。
【答案】a 2H++2e-=H2↑ b 27
【解析】
原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此解答。
(1)若电极a为Zn、电极b为Cu、电解质溶液为稀硫酸,由于金属性Zn>Cu,则锌是负极,铜是正极,所以该装置工作时,SO42-向负极即显a极移动,正极上氢离子放电,电极反应式为2H++2e-=H2↑。
(2)若电极a为Mg、电极b为Al、电解质溶液为氢氧化钠溶液,由于铝能与氢氧化钠溶液反应,则铝是负极,镁是正极,因此该原电池工作时,电子从b极流出。1mol铝在反应中失去3mol电子,一段时间后,若反应转移3NA个电子,则理论上消耗Al的物质的量是1mol,质量是27g。

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目