题目内容
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B. | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C. | 向NaHCO3溶液中滴加NaAlO2溶液 | 出现白色沉淀 | 酸性:HCO3->Al(OH)3 |
D. | 向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,再滴加2滴0.1 mol·L-1FeCl3溶液 | 先有白色沉淀生成后变为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
A. A B. B C. C D. D
【答案】C
【解析】A、还原产物是NO,在试管口被氧化为NO2,A错误;B、亚硫酸钠不是最高价含氧酸盐,不能比较二者的非金属性强弱,B错误;C、向NaHCO3溶液中滴加NaAlO2溶液,出现白色沉淀,说明有氢氧化铝生成,根据较强酸制备较弱酸原理可知酸性HCO3->Al(OH)3,C正确;D、反应中氢氧化钠过量,不能据此说明氢氧化镁沉淀转化为氢氧化铁,D错误,答案选C。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】下列 4个图像能正确反映对应变化关系是( )
A | B | C | D |
|
|
|
|
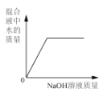
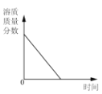
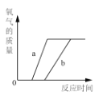
向一定量稀硫酸中加入 NaOH 溶液 | 浓硫酸长期暴露在空气中 | 向一定量的硫酸溶液中逐滴滴入氢氧化钡溶液至过量 | 相同条件下,加热等质量的两份固体,a为氯酸钾和二氧化锰的混合物,b 为氯酸钾 |
A. A B. B C. C D. D
【题目】甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)甲醇脱氢可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:

①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是____________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g)![]() HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程, 除去甲醇的离子方程式为 。