题目内容
【题目】【化学-选修3:物质结构与性质】
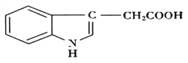
己知铜的配合物A(结构如下图1)。请回答下列问题:
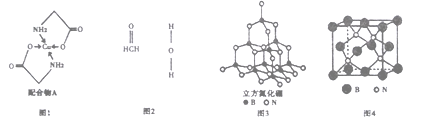
(l)Cu的简化电子排布式为_____________。
(2)A所含三种元素C、N、O的第一电离能由大到小的顺序为_________________。其中氮
原子的杂化轨道类型为_____________________。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目
之比是_____________; N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O
的电子式为____________________。
(4)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中H-C=O的键角___________1200(选填“大于”、“等于”或“小于”),甲醛能与水形成氢键,请在图2中表示出来___________。
(5)立方氮化硼(如图3)与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为__________;结构化学上用原子坐标参数表示晶胞内部各原子的相对位置,图4立方氮化硼晶胞中,B原子的坐标参数分别有:B(0,0,0);B(1/2,0,1/2);B(1/2,1/2,0)等。则距离上述三个B原子最近且等距的N原子的坐标参数为_______________。
【答案】 [Ar]3d104s1 N>O>C sp3 杂化 1:2 ![]() 大于
大于 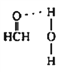 4:1 (1/4,1/4,1/4 )
4:1 (1/4,1/4,1/4 )
【解析】本题考查过渡元素Cu及其化合物的结构、电子排布、杂化轨道、晶体结构等物质结构的有关知识点。根据Cu的原子结构和电子排布规律、杂化轨道及分子构型的知识和晶体的类型以及晶包有关知识来解答此题。
(1)基态Cu原子核外有29个电子,外围电子排布式为3d104s1,全充满结构,稳定。简化电子排布式为[Ar]3d104S1
(2)同周期主族元素从左到右第一电离能呈增大趋势,第ⅡA族和第ⅤA族元素反常,N原子外围电子排布为2s22p3,为半充满结构,较稳定,N的电离能最大,C、N、O的第一电离能由大到小的顺序为N>O>C。氮原子有4个杂化轨道,所以为 SP3杂化
(3)N2的结构式为N≡N, 含1个σ键和2个π键,所以σ键和π键数目比为1:2,N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O结构与CO2相似,所以其结构为N=N=O,电子式为![]()
(4)甲醛分子中,碳原子为sp2杂化,分子成平面三角型,键角约120°,由于氧原子有孤电子对,对氢原子有排斥作用,所以OCH键角会稍大于120°,羰基氧有很强的电负性,与H2O中H有较强的静电吸引力,而形成氢键。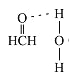
(5)由图可知,一个B原子与4个N原子形成4个B-N共价键,B-N键数与硼原子数之比为4:1,根据各个原子的相对位置可知,距离上述三个B原子最近且等距的N原子在x、y、z轴三个方向的1/4处,所以其坐标是(![]() ,
, ![]() ,
, ![]() )
)

【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B. | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C. | 向NaHCO3溶液中滴加NaAlO2溶液 | 出现白色沉淀 | 酸性:HCO3->Al(OH)3 |
D. | 向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,再滴加2滴0.1 mol·L-1FeCl3溶液 | 先有白色沉淀生成后变为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
A. A B. B C. C D. D