题目内容
【题目】下列 4个图像能正确反映对应变化关系是( )
A | B | C | D |
|
|
|
|
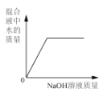
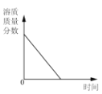
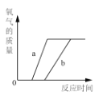
向一定量稀硫酸中加入 NaOH 溶液 | 浓硫酸长期暴露在空气中 | 向一定量的硫酸溶液中逐滴滴入氢氧化钡溶液至过量 | 相同条件下,加热等质量的两份固体,a为氯酸钾和二氧化锰的混合物,b 为氯酸钾 |
A. A B. B C. C D. D
【答案】C
【解析】
A项,硫酸溶液中含有水,酸碱反应后还生成水,因此水的质量不应从0开始;B项,浓硫酸具有吸水性,稀释后浓度变小,但不能变为0;C项,氢氧化钡与硫酸恰好完全反应生成硫酸钡和水,溶液的导电性几乎0,随着滴入氢氧化钡溶液的过量,溶液导电能力逐渐增强;D项,a为氯酸钾与二氧化锰混合物,a中氯酸钾的质量小于另一份b中氯酸钾质量,由于二氧化锰具有催化作用,所以等质量的两份固体加热后产生氧气的量不等,反应的速率也不等。
A项,硫酸溶液中本身就含有水,混合液中水的质量不从0开始,开始时加入的氢氧化钠溶液与稀硫酸反应生成水,这样溶液中增加的水有两个来源:氢氧化钠溶液中自带水、中和反应生成的水;而当加入的氢氧化钠将硫酸消耗完时,溶液中的水仍将增多,因为氢氧化钠溶液仍自带水;比较两个阶段水的增加趋势,图像的斜率在后一阶段将会减小;A错误;B项,浓硫酸暴露在空气中,会因吸水而被稀释,溶质质量分数的确下降;但当降低至一定程度之后,浓硫酸变为稀硫酸,不再具有吸水性,则溶质质量分数不再下降,溶质质量质量分数也不会降低到0,B错误;C项,要明确溶液的导电性和溶液中带电离子的浓度有关,向硫酸中加入氢氧化钡溶液,溶液中的离子不断减小;当两者恰好完全反应时,溶液中不再存在离子,导电性完全失去;继续加入氢氧化钡溶液,溶液中的离子浓度逐渐增大,导电性重新增强,C正确;D项,催化剂只能改变反应速率,并不能改变生成物的质量;而质量相等的两种固体,由于一份含有二氧化锰而另一份无,二氧化锰具有催化作用,所以含氯酸钾的质量必然不等,因此最终生成的氧气质量不可能相等, D错误;正确选项C。

【题目】某溶液中,若忽略水的电离,只含有下表中所示的四种离子,试推测X离子及其个数b可能为( )
离子 | Na+ | Al3+ | Cl﹣ | X |
个数 | 2a | a | a | b |
A.NO3﹣、2a
B.SO42﹣、2a
C.OH﹣、2a
D.SO42﹣、4a
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B. | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C. | 向NaHCO3溶液中滴加NaAlO2溶液 | 出现白色沉淀 | 酸性:HCO3->Al(OH)3 |
D. | 向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,再滴加2滴0.1 mol·L-1FeCl3溶液 | 先有白色沉淀生成后变为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
A. A B. B C. C D. D