题目内容
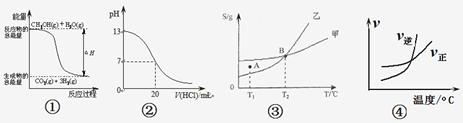
【题目】分析下图所示的四个原电池装置,其中结论正确的是
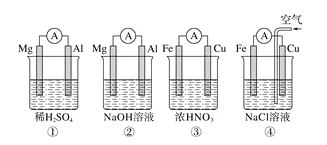
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为![]()
C.③中Fe作负极,电极反应式为![]()
D.④中Cu作正极,电极反应式为![]()
【答案】B
【解析】
A.![]() 中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,
中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,![]() 中金属铁在常温下遇浓硝酸钝化,铜是负极失去电子,故A错误;
中金属铁在常温下遇浓硝酸钝化,铜是负极失去电子,故A错误;
B.![]() 中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,Mg作为正极,电极反应式为
中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,Mg作为正极,电极反应式为![]() ,故B正确;
,故B正确;
C.金属铁在常温下遇浓硝酸钝化,铜是负极失去电子,故C错误;
D.铁、铜、氯化钠构成的原电池中,金属铁为负极,金属铜为正极,铁发生的是吸氧腐蚀,正极上是氧气得电子的过程,故D错误。
故选 B。

【题目】实验室模拟合成![]() 和CH3CH2CH2Br的方法如图1。
和CH3CH2CH2Br的方法如图1。
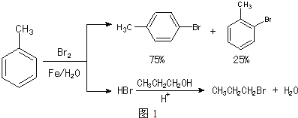
已知:甲苯和液溴在有少量水存在时也能反应(如图2):

实验室模拟合成对溴甲苯和1-溴丙烷的流程和相关数据如表:
物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |
(1)实验室存放液溴的试剂瓶需密闭,同时瓶中要加入____,以减少溴的挥发.写出甲苯和液溴反应生成对溴甲苯的化学方程式___。
(2)反应装置如图3所示:
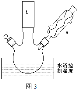
①图中玻璃仪器a的名称是____,方块b中为某玻璃仪器,其名称是___。
②三颈烧瓶中开始加入了甲苯、铁粉和水。加入的适量水的作用是:易于控制温度和____,加热搅拌操作中加入浓硫酸,完成1-丙醇的取代反应,浓硫酸的作用是____。
(3)操作I的名称是___,操作Ⅲ的名称是___。
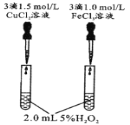
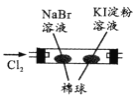
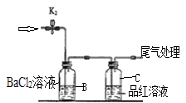
【题目】控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | B中产生白色沉淀,C中溶液颜色褪去 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | 硫酸亚铁铵分解的产物中除NH3外还含有SO3 和SO2 | 非金属性:C>Si |
A.AB.BC.CD.D