题目内容
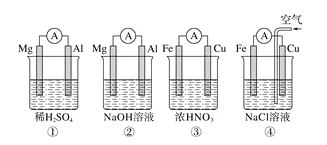
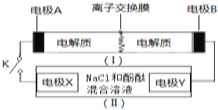
【题目】如图装置![]() Ⅰ
Ⅰ![]() 为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池工作的化学方程式为:
为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池工作的化学方程式为:![]() ,装置
,装置![]() Ⅱ
Ⅱ![]() 为电解池的示意图。当闭合开关K时,电极X附近溶液先变红则闭合K时,下列说法正确的是( )
为电解池的示意图。当闭合开关K时,电极X附近溶液先变红则闭合K时,下列说法正确的是( )
A.电极A上发生的电极反应式为:![]()
B.K+从右到左通过离子交换膜
C.电极X上发生的电极反应式为:![]()
D.当有0.1 mol ![]() 通过离子交换膜时,Y电极上产生2.24L(标准状况)气体
通过离子交换膜时,Y电极上产生2.24L(标准状况)气体
【答案】A
【解析】
当闭合开关K时,X附近溶液先变红,即X附近有氢氧根生成,所以在X极上得电子析出氢气,X极是阴极,Y极是阳极。与阴极连接的是原电池的负极,所以A极是负极,B极是正极。
A.A为原电池的负极,电极反应式为![]() ,故A正确;
,故A正确;
B.原电池工作时,阳离子向正极移动,K+应从左到右通过离子交换膜,故B错误;
C.X为电解池的阴极,发生反应为:![]() ,故C错误;
,故C错误;
D.当有0.1mol K+通过离子交换膜,即有0.1mol电子产生,根据氢气与电子的关系可知,生成的氢气体积为1.12L(标况下),故D错误;
故选:A。

【题目】Q、R、X、M、Y、Z是元素周期表前四周期的六种元素,原子序数依次递增。已知:
①Z位于ds区,最外能层没有单电子,其余的均为短周期主族元素;
②Y原子价电子排布为msnmpn(m≠n);
③M的基态原子2p能级有1个单电子;
④Q、X原子p轨道的未成对电子数都是2。
用化学术语回答下列问题:
(1)Z在周期表中的位置______________。
(2)Q、R、X、M四种元素第一电离能由大到小的顺序为__________ (用对应元素的符号填写)。
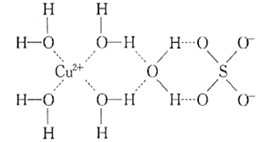
(3)X、M两元素形成的化合物XM2的VSEPR模型名称为_________,已知XM2分子的极性比水分子的极性弱,其原因是__________________。
(4)分析下表中两种物质的键能数据(单位:kJ/mol)。
A—B | A=B | A≡B | |
QX | 357.7 | 798.9 | 1 071.9 |
R2 | 154.8 | 418.4 | 941.7 |
①结合数据说明QX比R2活泼的原因:________________________。
②QX与R2互为等电子体,QX的结构式为(若有配位键请用→表示)______。Fe易与QX形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,则此配合物化学式为_______。