题目内容
【题目】在一定温度下,在某密闭容器内某一反应中M,N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( ) 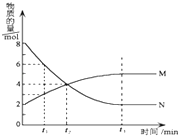
A.该反应的化学方程式为M═2N
B.若t1=1,则反应开始至t1时间段M 的反应速率为1mol﹒L﹣1﹒min﹣1
C.t2时正逆反应速率相等,反应达到平衡状态
D.t3时正反应速率等于逆反应速率
【答案】D
【解析】解:A.由图可知,△n(N)=8mol﹣2mol=6mol,△n(M)=5mol﹣2mol=3mol,N为反应物,M为生成物,变化量之比为2:1,即化学计量数之比为2:1,反应为2NM,故A错误;B.反应开始至t1时间段M 的反应速率v(M)= ![]() ,V不知,因此无法计算出1mol﹒L﹣1﹒min﹣1 , 故B错误;
,V不知,因此无法计算出1mol﹒L﹣1﹒min﹣1 , 故B错误;
C.t2之后M、N的物质的量还在变化,因此反应没有达到平衡状态,t2时正逆反应速率不相等,故C错误;
D.t3时M、N的物质的量不随时间改变而改变,反应达到化学平衡状态,正反应速率等于逆反应速率,故D正确;
故选D.
【考点精析】关于本题考查的反应速率的定量表示方法,需要了解反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t才能得出正确答案.

练习册系列答案
相关题目


