题目内容
【题目】一定条件下,向密闭容器中充入1mol NO和1mol CO进行反应:NO(g)+CO(g) ![]() N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是( )
N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是( ) 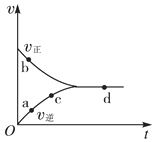
A.a点
B.b点
C.c点
D.d点
【答案】D
【解析】解:由图可知,a、b、c点的正反应速率均大于逆反应速率,只有d点正逆反应速率相等,由正逆反应速率相等的状态为平衡状态可知,图中处于化学平衡状态的点是d点,
故选D.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素.
元素 | 相关信息 |
A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂. |
D | 室温下其单质呈粉末固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
E | 它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等. |
(1)E在元素周期表中的位置是 .
(2)B和D对应的气态氢化物中,稳定性强的是 , 熔沸点高的是(用具体的化学式表示).
(3)D的单质与烧碱水溶液加热时发生自身氧化还原反应生成两种具有强还原性的阴离子,写出该反应的离子方程式 .
(4)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1:2)一起用作火箭助推剂,写出两者发生反应生成无毒物质的化学方程式 .
(5)以上这五种元素组成一种工业上用途极广的复盐,该物质中A、B、C、D、E的质量比为5:56:7:16:14.则其水溶液的pH7(填“>”“=”或“<”),原因是(用离子方程式表示).溶液中离子浓度从大到小的顺序为 .