题目内容
5.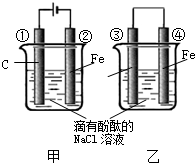 化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.(1)把化学能转化为电能的装置是乙C(填“甲”或“乙”)
(2)④电极上的电极反应式为Fe-2e-═Fe2+
(3)①电极上的电极反应式为2Cl--2e-═Cl2
(4)甲、乙两装置电极附近的溶液首先变红的电极分别是②、③(填序号)
(5)写出装置甲的反应总方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
分析 (1)没有外接电源且能自发进行氧化还原反应的装置为原电池;
(2)乙装置为原电池,铁易失电子作负极,碳作正极;
(3)甲装置为电解池,碳作阳极,阳极上氯离子放电;
(4)有氢氧根离子生成的电极附近溶液先变红;
(5)甲装置中,阳极上氯离子放电,阴极上氢离子放电.
解答 解:(1)没有外接电源且能自发进行氧化还原反应的装置为原电池,原电池将化学能转化为电能,乙装置能自发进行氧化还原反应,符合原电池条件,所以乙属于原电池,故答案为:乙;
(2)乙装置为原电池,铁易失电子作负极,碳作正极,所以④电极上电极反应式为:Fe-2e-═Fe2+,故答案为:Fe-2e-═Fe2+;
(3)甲装置为电解池,碳作阳极,阳极①上氯离子放电生成氯气,电极反应式为2Cl--2e-═Cl2↑,氯气和碘离子反应生成碘单质,碘遇淀粉试液变蓝色,所以可以用湿润的淀粉碘化钾试纸检验,如果试纸变为蓝色,说明有氯气生成,
故答案为:2Cl--2e-═Cl2↑;
(4)甲装置中,阴极上氢离子放电,同时电极附近生成氢氧根离子,乙装置中碳电极上氧气得电子和水反应生成氢氧根离子,酚酞试液遇碱变红色,所以甲、乙两装置电极附近的溶液首先变红的电极分别是②、③,故答案为:②;③;
(5)甲装置中,阳极上氯离子放电,阴极上氢离子放电生成氢气,所以电池反应式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
点评 本题考查了原电池和电解池原理,根据是否有外接电源判断原电池和电解池,再结合各个电极上发生的反应来分析解答,知道氯气的检验方法,题目难度不大.

| A. | 含有较多钙、镁离子的水叫做硬水 | |
| B. | 热水瓶使用时间长了瓶胆内壁会产生一层水垢,其主要成分是CaCO3和MgCO3 | |
| C. | 硬水对生产生活带来许多不便,如在硬水中用肥皂洗涤衣物,不但难以洗净,还会使衣物变硬;煮硬水的锅炉要多用燃料,严重时可能造成锅炉爆炸等 | |
| D. | 生活中可以采用不同的方法将硬水软化,如煮沸法,磺化煤离子交换法等 |
| A. | 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量 | |
| B. | 书写热化学方程式时,不仅要写明反应热的符号、数值和单位,还要注明各物质的聚集状态 | |
| C. | 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据 | |
| D. | 凡是化合反应都是放热反应,分解反应都是吸热反应 |
| A. | CH4+Cl2→CH3 Cl+HCl | |
| B. | 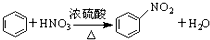 | |
| C. | 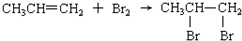 | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O |
| A. | 熔点:金刚石>金属钠>干冰 | B. | 离子半径:S2-<Cl-<K+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 热稳定性:CH4<NH3<H2O |
| A. | 加热使氧化镁熔化不需要破坏化学键 | |
| B. | 分子间作用力比化学键强的多 | |
| C. | 加热使冰融化主要破坏分子间作用力 | |
| D. | 化学键是指物质中相邻的原子或离子间的强烈的吸引作用 |
| 操作 | 实验现象 | 结论 | |
| A | 将铝片放入盐酸中 | 产生气泡的速率开始时较慢,随后加快,后来又逐渐减慢 | H+的浓度是影响反应速率的唯一因素 |
| B | 将形状大小相近的Mg和Al片分别放入相同浓度的盐酸中 | Mg与盐酸反应比Al剧烈 | Mg比Al的金属性强 |
| C | 氢气在氯气中点燃 | 有苍白色火焰,瓶口有白雾 | 其中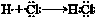 过程 过程吸收能量 |
| D | 将一小块钠投入冷水中 | 钠熔化成小球 | 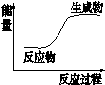 |
| A. | A | B. | B | C. | C | D. | D |
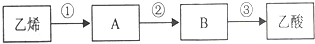 乙烯是重要的石油化工产品.回答下列问题.
乙烯是重要的石油化工产品.回答下列问题.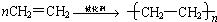 ,反应类型是加聚反应.
,反应类型是加聚反应.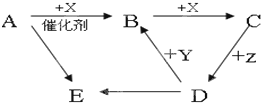 现有A、B、C、D、E五种物质,它们均含同一种元素,有以下转化关系:已知A、B、C、X在常温下为气体,Z为液体,Y为紫红色金属,A与D的浓溶液相遇会产生白烟E.
现有A、B、C、D、E五种物质,它们均含同一种元素,有以下转化关系:已知A、B、C、X在常温下为气体,Z为液体,Y为紫红色金属,A与D的浓溶液相遇会产生白烟E.