题目内容
14.下列说法正确的是( )| A. | 加热使氧化镁熔化不需要破坏化学键 | |
| B. | 分子间作用力比化学键强的多 | |
| C. | 加热使冰融化主要破坏分子间作用力 | |
| D. | 化学键是指物质中相邻的原子或离子间的强烈的吸引作用 |
分析 A.离子晶体熔化破坏离子键;
B.分子间作用力远小于化学键;
C.分子晶体熔化时破坏分子间作用力;
D.化学键中包含引力和斥力.
解答 解:A.离子晶体熔化破坏离子键,所以加热使氧化镁熔化需要破坏化学键,故A错误;
B.分子间作用力是分子间较弱的相互作用,化学键是相邻原子或离子间强烈的相互作用,分子间作用力远小于化学键,故B错误;
C.分子晶体熔化时破坏分子间作用力,冰属于分子晶体,则加热使冰融化主要破坏分子间作用力,故C正确;
D.化学键中包含引力和斥力,化学键是指物质中相邻的原子或离子间的强烈的相互作用,故D错误.
故选C.
点评 本题考查了化学键、分子间作用力,题目难度不大,注意把握化学键与分子间作用力的区别.

练习册系列答案
相关题目
4.下列有关电化学的叙述正确的是( )
| A. | 在原电池的负极和电解池的阴极上都发生氧化反应 | |
| B. | 镀层被破坏后,镀锡铁板比镀锌铁板更耐腐蚀 | |
| C. | 氢氧燃料电池的负极上发生的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 用惰性电极电解饱和食盐水时,若转移电子数为6.02×1023,则生成NaOH的物质的量为1mol |
2.已知:4A(g)+5B(g)═4C(g)+6D(g),如果反应速率分别用V(A)、V(B)、V(C)、V(D)表示,正确的关系是( )
| A. | $\frac{4}{5}$ V(A)=V(B) | B. | $\frac{5}{6}$V(B)=V(D) | C. | $\frac{2}{3}$ V(A)=V(D) | D. | $\frac{4}{5}$ V(B)=V(C) |
9.下列各项比较中,正确的是( )
| A. | 原子核外电子数:N>O>F | B. | 元素最高化合价:Na<Mg<Al | ||
| C. | 热稳定性:HI>HCl>HF | D. | 酸性:H3PO4<H2SO4<HClO |
6.下列变化不需要破坏化学键的是( )
| A. | HCl气体溶于水 | B. | 加热HI气体使之分解 | ||
| C. | NaCl溶于水 | D. | 碘晶体受热转变成碘蒸气 |
3.下列第三周期元素中,非金属性最弱的是( )
| A. | 硅 | B. | 氯 | C. | 磷 | D. | 硫 |
4.下列不属于配位化合物的是 ( )
| A. | 六氟合铝酸钠:Na3[AlF6] | B. | 氢氧化二氨合银:[Ag(NH3)2]OH | ||
| C. | 六氟合铁酸钾:K3[FeF6] | D. | 十二水硫酸铝钾:KAl(SO4)2•12H2O |
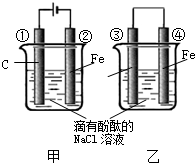 化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置. 图中线段分别是A,B,C是在2L容器中的物质的量随时间的变化曲线.由图中数据分析:
图中线段分别是A,B,C是在2L容器中的物质的量随时间的变化曲线.由图中数据分析: