题目内容
20.下列反应属于加成反应的是( )| A. | CH4+Cl2→CH3 Cl+HCl | |
| B. | 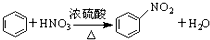 | |
| C. | 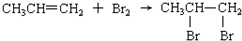 | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O |
分析 有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应,根据定义分析解答.
解答 解:A.CH4+Cl2→CH3Cl+HCl,反应中CH4分子的氢原子被氯原子取代,属于取代反应,不属于加成反应,故A错误;
B. ,反应中苯环上的氢原子被硝基取代,属于取代反应,不属于加成反应,故B错误;
,反应中苯环上的氢原子被硝基取代,属于取代反应,不属于加成反应,故B错误;
C.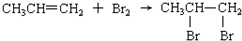 ,丙烯分子中C=C双键其中1个C-C断裂分别结合溴原子生成1,2-二溴乙烷,属于加成反应,故C正确;
,丙烯分子中C=C双键其中1个C-C断裂分别结合溴原子生成1,2-二溴乙烷,属于加成反应,故C正确;
D.CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,乙酸中羧基上的羟基被-OC2H5取代,属于取代反应,不是加成反应,故D错误;
故选C.
点评 本题考查有机物的性质、有机反应类型,题目难度不大,注意理解常见有机反应类型,明确加成反应与其它反应类型的区别.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
10.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 常温常压下,18g NH4+所含的电子数为10NA | |
| B. | 56g金属铁与足量的稀盐酸反应时转移的电子数为3NA | |
| C. | 标准状况下,22.4L氧气所含的氧原子数为2 NA | |
| D. | 1 mol由Na2O2和Na2O组成的混合物,其中的钠离子数为4 NA |
11.下列药品属于国际奥委会严格禁止的兴奋剂是( )
| A. | 阿司匹林 | B. | 青霉素 | C. | 氢氧化铝 | D. | 麻黄碱 |
8.已知:合成氨反应(即N2+3H2═2NH3)为放热反应.反应过程中断裂1molN≡N消耗的能量为Q1kJ,断裂1molH-H消耗的能量为Q2kJ,断裂1molN-H消耗的能量为Q3kJ.下列关系式中正确的是( )
| A. | Q1+3Q2<6Q3 | B. | Q1+3Q2>2Q3 | C. | 3Q1+Q2>6Q3 | D. | Q1+3Q2<2Q3 |
15.镁、铝是常见的两种金属,它们组成合金是现代科技的重要材料.
I、镁的金属性比铝的更强.
(1)请从原子结构的角度解释镁的金属性比铝强的原因.答:镁铝原子核外电子层数相同,与铝相比,镁原子半径更大,失去电子能力更强.
II、现有四块相同的镁铝合金(假设质量均为Xg).为测定该合金中铝的质量分数,四个同学各取一块合金,并按下述四种不同的方案进行实验:
甲:将合金溶于足量的盐酸,测得生成气体的体积为VL(标况下);
乙:将合金溶于足量的NaOH溶液中,测得剩余固体的质量为Yg;
丙:将合金溶于足量的盐酸,再加入足量的NaOH溶液后过滤,测得沉淀质量为Zg;
丁:将合金溶于足量的盐酸,再加入足量的氨水后过滤,测得沉淀质量为Wg;
(2)乙方案中反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+H2↑.
(3)四种方案中,可测出合金中铝的质量分数的是甲、乙、丙、丁(填实验方案代号).
(4)选择一种可测出合金中铝的质量分数的方案,并利用相关量,计算该合金中铝的质量分数,并填入下表中:
(5)方案乙中,浸泡于氢氧化钠溶液中的合金与氢氧化钠溶液构成了原电池.对于该原电池,其负极的电极反应式为2Al+8OH--6e-=2AlO2-+4H2O.
I、镁的金属性比铝的更强.
(1)请从原子结构的角度解释镁的金属性比铝强的原因.答:镁铝原子核外电子层数相同,与铝相比,镁原子半径更大,失去电子能力更强.
II、现有四块相同的镁铝合金(假设质量均为Xg).为测定该合金中铝的质量分数,四个同学各取一块合金,并按下述四种不同的方案进行实验:
甲:将合金溶于足量的盐酸,测得生成气体的体积为VL(标况下);
乙:将合金溶于足量的NaOH溶液中,测得剩余固体的质量为Yg;
丙:将合金溶于足量的盐酸,再加入足量的NaOH溶液后过滤,测得沉淀质量为Zg;
丁:将合金溶于足量的盐酸,再加入足量的氨水后过滤,测得沉淀质量为Wg;
(2)乙方案中反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+H2↑.
(3)四种方案中,可测出合金中铝的质量分数的是甲、乙、丙、丁(填实验方案代号).
(4)选择一种可测出合金中铝的质量分数的方案,并利用相关量,计算该合金中铝的质量分数,并填入下表中:
| 你选择的方案 | 合金中铝的质量分数 |
| 甲或乙或丙或丁 | $\frac{3.214V}{X}-3$或$\frac{X-Y}{X}$或$\frac{29X-12Z}{29X}$或$\frac{36W-87X}{17X}$ |
9.下列各项比较中,正确的是( )
| A. | 原子核外电子数:N>O>F | B. | 元素最高化合价:Na<Mg<Al | ||
| C. | 热稳定性:HI>HCl>HF | D. | 酸性:H3PO4<H2SO4<HClO |
10.下列有关实验装置或实验操作正确的是( )
 |  |  | 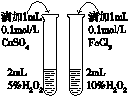 |
| 验证酸性: H2CO3>H2SiO3 | 用于分离CCl4萃取碘水后的有机层和水层 | 证明石蜡油分解生成的气体是乙烯 | 比较不同催化剂 对反应速率的影响 |
| A | B | C | D |
| A. | A | B. | B | C. | C | D. | D |
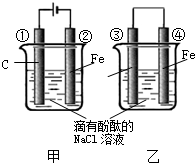 化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.